
| A. | 一定是ⅠA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能不是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 若a=b且pH(NaX)>pH(NaY),则酸性HX<HY | |
| B. | 若a=b且c(X -)=c(Y -)+c(HY),则酸性HX>HY | |
| C. | 若a>b且c(X -)=c(Y -),则酸性HX<HY | |
| D. | 若a=0.1mol/L且两溶液等体积混合,则c(X -)+c(HX)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
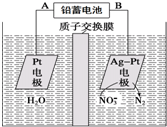
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的总反应方程式为:2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| C. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们的原子序数B>A>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 回答下列问题.
回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 23g Na在空气中完全燃烧,转移的电子数为1 mol | |
| B. | 78gNa2O2含有的离子数为3NA | |
| C. | 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1NA | |
| D. | 5.4 g铝与足量NaOH溶液反应,产生6.72L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | 常温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 浓度均为0.1mol/L的①NH4Cl ②NH3•H2O ③NH4HSO4 ④NH4HCO3四种溶液,c(NH4+)由大到小的顺序为:③>①>④>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com