
 (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.分析 (1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
(2)①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2先不考虑水解,则①(NH4)2CO3含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,溶液中c(NH4+)根据盐类水解的影响分析判断;
(3)①饱和的FeCl3溶液滴入沸水中反应生成氢氧化铁胶体;
②碳酸氢钠溶液中存在电离是碳酸氢钠完全电离,碳酸氢根离子部分电离;
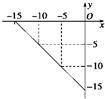
(4)①图中数据计算离子积常数=c(H+).c(OH-),根据离子积常数计算氢离子浓度,进而求pH;
②设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比.
解答 解:(1)1g CH4完全燃烧生成液态水和CO2气体,放出55.6kJ的热量,则1mol即16g CH4完全燃烧生成液态水和CO2气体,16×55.6kJ=889.6kJ,则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1;
(2)物质的量浓度相同的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2;先不考虑水解,则(NH4)2CO3 中含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,②④二种物质中,④NH4Fe(SO4)2酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH4+)较大,
①NH4Cl,NH4+水解,②NH4HCO3,碳酸氢根离子的水解对铵根离子起促进作用,即溶液中c(NH4+)④>③>②;
按c(NH4+)由大到小的顺序排列为:①>④>③>②,
故答案为:①④③②;
(3)①饱和的FeCl3溶液滴入沸水中反应生成氢氧化铁胶体 的离子方程式为:Fe3++3 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
②碳酸氢钠溶液中存在电离是碳酸氢钠完全电离,碳酸氢根离子部分电离;电离方程式为:NaHCO3=HCO3-+Na+,HCO3-?CO32-+H+,
故答案为:NaHCO3=HCO3-+Na+,HCO3-?CO32-+H+;
(4)①根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5×10-10=10-15,
中性溶液中,c(H+)=c(OH-)=$\sqrt{1{0}^{-15}}$=10-7.5,pH=-lg10-7.5=7.5,
故答案为:7.5;
②设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-7mol/L,
pH=6的稀盐酸溶液中c(H+)=1×10-6mol/L,
欲使混合溶液pH=7<7.5,溶液此时显酸性,即混合后c(H+)=1×10-7mol/L,即$\frac{1{0}^{-6}y-1{0}^{-7}x}{x+y}$=1×10-5mol/L,解得x:y=9:2,
故答案为:9:2.
点评 本题考查盐类水解的原理和应用,水的电离平衡分析,离子积常数的计算应用,注意离子积是一定温度下的常数,随温度改变,盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析离子浓度的大小比较是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/LCH3COOH溶液中含有0.1NA个氢离子 | |
| B. | 25℃是PH=13的Ba(OH)2溶液中含有0.1NA个OH- | |
| C. | 8.4gNaHCO3固体中含有0.1NA 个CO32- | |
| D. | 25℃,PH=11的Na2CO3溶液1L中由水电离出的H+的数目为10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com