
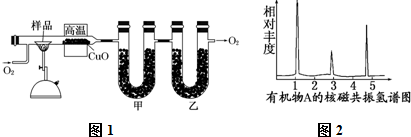
分析 (1)(2)在氧气流中全部氧化为CO2和H2O,通过测定生成的CO2、H2O的量确定实验式,用氯化钙吸收水蒸气,用氢氧化钠吸收二氧化碳,由于二氧化碳会吸收水蒸气,故先用氯化钙吸收水蒸气,再用氢氧化钠吸收二氧化碳.由于装置内有空气,会影响水蒸气、二氧化碳质量测定,实验开始时,要先通入氧气排尽装置内空气;
(3)计算生成水、二氧化碳的物质的量,根据质量守恒判断是否含有O元素,若含有元素,计算原子物质的量;
(4)根据原子数目之比确定有机物最简式,若最简式中H原子已经饱和C的四价结构,则最简式均为分子式,否则需要知道有机物相对分子质量来确定分子式,有机物A的核磁共振氢谱有3个吸收峰,说明含有3种H原子.
解答 解:(1)因为氢氧化钠能同时吸收CO2和H2O,从而无法确定生成水和CO2的质量,故先用氯化钙吸收水蒸气,再用氢氧化钠吸收二氧化碳,
故答案为:CaCl2;不能;因为氢氧化钠能同时吸收CO2和H2O,从而无法确定生成水和CO2的质量;
(2)将装置中的空气排尽,否则会因空气中含有二氧化碳和水蒸气而影响测定结果的准确性,
答:将装置中的空气排尽,否则会因空气中含有二氧化碳和水蒸气而影响测定结果的准确性;
(3)生成水物质的量为$\frac{5.4g}{18g/mol}$=0.3mol,H原子物质的量为0.6mol,生成二氧化碳为$\frac{8.8g}{44g/mol}$=0.2mol,碳原子物质的量为0.2mol,氧原子物质的量为$\frac{4.6g-0.6mol×1g/mol-0.2mol×12g/mol}{16g/mol}$=0.1mol,故有机物A中N(C):N(H):N(O)=0.2:0.6:0.1=2:6:1,
故答案为:N(C):N(H):N(O)=2:6:1;
(4)由于有机物A否则中N(C):N(H):N(O)=2:6:1,H原子已经饱和碳的四价结构,则有机物分子式为或C2H6O,有机物A的核磁共振氢谱有3个吸收峰,说明含有3种H原子,则有机物的结构简式为:CH3CH2OH,
故答案为:CH3CH2OH.
点评 本题考查燃烧法确定有机物的组成、对实验原理装置的理解等,难度中等,理解实验原理是解题的关键.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 02是还原剂 | B. | FeS2是氧化剂 | ||
| C. | 02失去电子 | D. | FeS2发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 当各轨道处于全满.半满.全空时原子较稳定 | |
| D. | 同一周期中,碱金属元素的第一电离能最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数相等 | |
| C. | 22.4L的CO气体与1molN2所含的电子数相等 | |
| D. | 任何条件下,16gCH4与18gH2O所含有电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:KOH>NaOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I->Br ->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 (-R为烃基)
(-R为烃基)
 +CH3CH2Cl
+CH3CH2Cl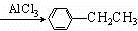 +HCl.
+HCl.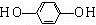 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
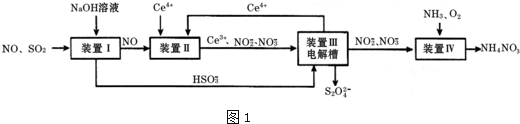
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制的Cu(OH)2可鉴别乙醛、乙酸、乙醇 | |
| B. | 除去乙烷中少量乙烯:光照条件下通入Cl2,气液分离 | |
| C. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| D. | 除去苯中混有的苯酚:向混合液中加入过量的NaOH溶液,充分反应后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
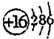 .
.
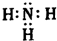 .化合物X的电子式
.化合物X的电子式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com