
 CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol���� CO2(g) + H2(g)
CO2(g) + H2(g)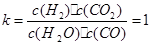
 CO2(g) + H2(g)
CO2(g) + H2(g)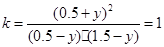


 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д� Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�T��ʾ�¶ȣ������н�����ȷ����
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�T��ʾ�¶ȣ������н�����ȷ����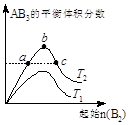
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)����H��0���ﵽƽ��ʱ������˵����ȷ���ǣ�
2Z(g)����H��0���ﵽƽ��ʱ������˵����ȷ���ǣ�| A����С���������ƽ�������ƶ� | B�����������Z�IJ������� |
| C������c(X)��X��ת�������� | D�������¶ȣ�Y��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
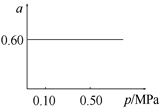
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(��) ��H ��0����ƽ������������г��� amolC(g),�ٴ�ƽ�����ԭƽ��Ƚϣ�����������ȷ����
2C(��) ��H ��0����ƽ������������г��� amolC(g),�ٴ�ƽ�����ԭƽ��Ƚϣ�����������ȷ����| A��ƽ����Է���������С | B�� C��ת�������� |
| C�� C�������������� | D����Ӧ�ȴ���ԭ����2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C(g)+D(g)���ﵽƽ��ʱ��C��Ũ��ΪW mol/L����ά������������¶Ȳ��䣬���������ַ����ı���ʼ���ʣ��ﵽƽ���C��Ũ����ΪWmol/L����
3C(g)+D(g)���ﵽƽ��ʱ��C��Ũ��ΪW mol/L����ά������������¶Ȳ��䣬���������ַ����ı���ʼ���ʣ��ﵽƽ���C��Ũ����ΪWmol/L����| A��4molA+2molB | B��2molA+1molB+3molC+1molD |
| C��3molC+1molD+1molB | D��3molC+1molD |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��N2��H2��ת���ʲ���� | B��ƽ��ʱ��H2��NH3����������֮��Ϊ3:2 |
| C��x : y =1:3 | D��x��ȡֵ��ΧΪ0��x��0.14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
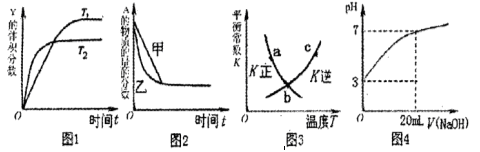
A��ͼ1��ʾ���淴Ӧ �¶� �¶�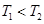 ������ ������ |
B��ͼ2��ʾѹǿ�Կ��淴Ӧ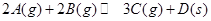 ��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ�� ��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ�� |
| C��ͼ3��a��b��c������ֻ��b���Ѿ��ﵽ��ѧƽ��״̬ |
| D��ͼ4����20mL pH=3�Ĵ�����Һ�еμ�pH=11��NaOH��Һ������pH�仯���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3FcS(s)+4H2O(g) ��H=a kJ ? mol-1
3FcS(s)+4H2O(g) ��H=a kJ ? mol-1 2FeS(s)+3H2O(g) ��H=bkJ ? mol-1
2FeS(s)+3H2O(g) ��H=bkJ ? mol-1 FeS(s)+H2O(g) ��H=ckJ�� mol-1
FeS(s)+H2O(g) ��H=ckJ�� mol-1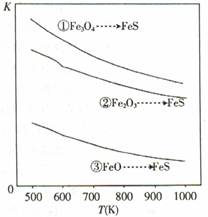
| A��a��b��c����0 |
| B��ѹǿԽ��H2S���ѳ���Խ�� |
| C���¶�Խ�ߣ�H2S���ѳ���Խ�� |
| D����Ӧ�١��ڡ��۵�ƽ�ⳣ������ʽ��ͬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com