
| A. | 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H>0 | |
| C. | 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)?PCl5(g),压缩体积,平衡正向移动,K值增大 | |
| D. | 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN) |
分析 A、形成原电池可以加快反应速率;
B、反应能否自发进行的判据:△H-T△S<0,据此回答;
C、平衡常数只受温度的影响,和压强无关;
D、Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,HClO溶液的酸性大于HCN,根据越弱越水解原理来回答.
解答 解:A、实验室用Zn和稀硫酸制H2,向稀硫酸中加入少量Cu,可以形成原电池,加快金属锌和酸反应的速率,故A正确;
B、反应能否自发进行的判据:△H-T△S<0,反应CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)是熵减的反应,该反应的△H<0,故B错误;
C、在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)?PCl5(g),压缩体积,平衡正向移动,K值不变,故C错误;
D、25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,HClO溶液的酸性大于HCN,根据越弱越水解原理,该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)>c(NaCN),故D错误.
故选A.
点评 本题涉及盐的水解原理的应用、反应自发性的判断以及影响反应速率的因素等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | NaCl晶体由Na+和Cl-组成,NaCl晶体是电的良导体 | |
| C. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| D. | pH=3是醋酸稀释至100倍,pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液呈酸性:NaHSO3═Na++H++S032- | |
| B. | 向Na2SiO3溶液中通人少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 将一小块钠投入稀醋酸中:2Na+2H+═2Na++H2 | |
| D. | 在Na2S203溶液中滴加稀硝酸:2H++S2O32-═S+SO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
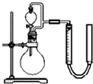 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
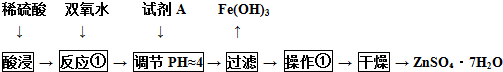
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液中:Fe2+、K+、NO3-、SO42- | |
| B. | 使酚酞试液变红色的溶液中:Na+、Ba2+、NO3-、Cl- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、Cl-、SCN-、SO42- | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 向容器中再加入N2可以加快反应速率 | |
| C. | 达到化学反应限度时,生成2 mol NH3 | |
| D. | 达到化学平衡时 N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色带橡胶塞的试剂瓶中 | |
| B. | 漂粉精露置在空气中 | |
| C. | 烧碱溶液可保存在带玻璃塞试剂瓶中 | |
| D. | 可用铝制容器存放浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该现象说明了NaHCO3难溶于水 | |
| B. | 滤液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 滤液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 滤液中c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com