
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
【答案】A
【解析】A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合反应生成NaCl和CH3COOH,醋酸是弱电解质存在电离平衡,溶液呈酸性,溶液中离子浓度c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣),所以A正确; B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7),说明溶液中一水合氨电离大于铵根离子水解溶液呈碱性,c(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣),所以B错误;
C、0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:n(Na):n(C)=3:2,溶液中物料守恒得到:2c(Na+)=3[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)],所以C错误;
D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸)反应生成氯化钠、NaHC2O4 , 溶液中存在电荷守恒为:c(Cl﹣)+2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+),所以D错误;所以选A.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)=3Ca2+(aq)+2PO43﹣(aq)
①溶度积Ksp=;
②若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 molL﹣1 , c(PO43﹣)=1.58×10﹣6 molL﹣1 , 则Ksp= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化铵 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
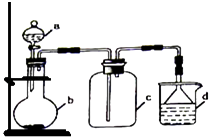
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.医疗上常用碳酸钡作X射线透视肠胃的内服药剂,即钡餐
B.碘有“智慧元素”之称,故所有食品都应加碘
C.氮氧化物、硫氧化物和碳氧化物是造成酸雨的主要物质
D.硅的提纯与应用,促进了半导体元件与集成芯片的发展
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式H++OH-=H2O表示的反应是
A. 稀醋酸和稀氨水反应 B. 稀硫酸和烧碱溶液反应
C. 稀盐酸和氢氧化铜反应 D. 稀硫酸和氢氧化钡溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下.
提出猜想:
问题1:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题2:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ.解决问题1取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式: ,
(2)从实验Ⅰ可得出的结论是
(3)Ⅱ.解决问题2
设计如下装置(夹持装置未画出):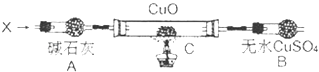
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g单质气体Y.
X气体的摩尔质量是 .
(4)C中发生反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com