
12 gijӊ»śĪļXĶźČ«Č¼ÉÕŗóÉś³É17.6 g CO2ŗĶ7.2 g H2O”£
(1)Čē¹ūXŹĒÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĪŽÉ«ŅŗĢ壬Óė½šŹōÄĘ”¢Ģ¼ĖįÄĘ¾łÄÜ·“Ó¦²¢·Å³öĘųĢ壬ŌņĖüµÄ½į¹¹¼ņŹ½ĪŖ____________________”£
(2)Čē¹ūXŹĒŅ×»Ó·¢ÓŠ¹ūĻćĪ¶µÄĪŽÉ«ŅŗĢ壬²¢ÄÜĖ®½ā£¬ŌņĖüµÄ½į¹¹¼ņŹ½ĪŖ______”£
(3)Čē¹ūXµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ90£¬øś“¼”¢ōČĖį¶¼ÄÜ·¢Éśõ„»Æ·“Ó¦£¬ĒŅĮ½·Ö×ÓµÄXÖ®¼ä»„Ļą·“Ӧɜ³ÉČēĻĀ»·õ„£ŗ £¬ŌņXµÄ½į¹¹¼ņŹ½ĪŖ________________”£
£¬ŌņXµÄ½į¹¹¼ņŹ½ĪŖ________________”£
½āĪö””n(C)”Ćn(H)”Ćn(O)£½(17.6/44)”Ć(7.2/18”Į2)”Ć[(12£17.6/44”Į12£7.2/18”Į2)”Ā16]£½1”Ć2”Ć1£¬¹Ź×ī¼ņŹ½ĪŖCH2O”£(1)ÄÜÓė½šŹōÄĘ”¢Ģ¼ĖįÄĘ·“Ó¦£¬ĖµĆ÷ŗ¬”ŖCOOH£¬ĪŖCH3COOH£»(2)ÓŠ¹ūĻćĪ¶µÄĪļÖŹŹĒõ„£¬Ó¦øĆĪŖHCOOCH3£»(3)Ļą¶Ō·Ö×ÓÖŹĮæĪŖ90ÓÖĶ¬Ź±¾ßÓŠ”ŖOHŗĶ”ŖCOOHĒŅ·ūŗĻ×ī¼ņŹ½CH2OµÄĪļÖŹŹĒCH3CH(OH)COOH»ņHOCH2CH2COOH£¬½įŗĻĢāÖŠ»·õ„µÄ½į¹¹æÉÖŖ£¬Ö»ÄÜŹĒCH3CH(OH)COOH”£
“š°ø””(1)CH3COOH””(2)HCOOCH3
(3)CH3CH(OH)COOH



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŠšŹöÖŠ£¬ÕżČ·µÄŹĒ(””””)
A£®C4H10µÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåÖ»ÄÜÉś³ÉŅ»ÖÖĀČ“śĪļ
B£®CH3”ŖCH===CH”ŖC”ŌC”ŖCF3·Ö×Ó½į¹¹ÖŠ6øöĢ¼Ō×ÓæÉÄܶ¼ŌŚŅ»ĢõÖ±ĻßÉĻ
C£®Ä³ĪļÖŹµÄĆū³ĘĪŖ2ŅŅ»ł1¶”Ļ©£¬ĖüµÄ½į¹¹¼ņŹ½ĪŖ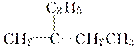
D£®ÖĘČ”1,2¶žäåŅŅĶéµÄ×īŗĻĄķµÄ·½·ØŹĒŅŅĻ©ÓėHBr½ųŠŠ¼Ó³É·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖX”¢YŹĒÖ÷×åŌŖĖŲ£¬IĪŖµēĄėÄÜ£¬µ„Ī»ŹĒkJ”¤mol£1”£Ēėøł¾ŻĻĀ±ķĖłĮŠŹż¾ŻÅŠ¶Ļ£¬“ķĪóµÄŹĒ (””””)”£
| ŌŖĖŲ | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.ŌŖĖŲXµÄ³£¼ū»ÆŗĻ¼ŪŹĒ£«1¼Ū
B£®ŌŖĖŲYŹĒ¢óA×åŌŖĖŲ
C£®ŌŖĖŲXÓėĀČŠĪ³É»ÆŗĻĪļŹ±£¬»ÆѧŹ½æÉÄÜŹĒXCl
D£®ČōŌŖĖŲY“¦ÓŚµŚČżÖÜĘŚ£¬ĖüæÉÓėĄäĖ®¾ēĮŅ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĪļÖŹÖŠ£¬²»ÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«µÄĪļÖŹŹĒ
(””””)”£
¢Ł ””¢ŚŅŅĻ©””¢ŪCH3COOH””¢ÜCH3CH2OH¢ŻCH2===CH”ŖCOOH””¢Ž
””¢ŚŅŅĻ©””¢ŪCH3COOH””¢ÜCH3CH2OH¢ŻCH2===CH”ŖCOOH””¢Ž
A£®¢Ł¢Ż B£®¢Ł¢Ś¢Ü¢Ž C£®¢Ł¢Ü D£®¢Ł¢Ū¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Į½ÖÖĘųĢ¬ĢžŅŌČĪŅā±ČĄż»ģŗĻ£¬ŌŚ105 ”ꏱ1 LøĆ»ģŗĻĢžÓė9 LŃõĘų»ģŗĻ£¬³ä·ÖČ¼ÉÕŗó»Öø“µ½ŌדĢ¬£¬ĖłµĆĘųĢåĢå»żČŌŹĒ10 L”£ĻĀĮŠø÷×é»ģŗĻĢžÖŠ²»·ūŗĻ“ĖĢõ¼žµÄŹĒ
(””””)”£
A£®CH4ÓėC2H4 B£®CH4ÓėC3H4
C£®C2H2ÓėC3H6 D£®C2H4ÓėC3H4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚæÉÄę·“Ó¦CO(g)£«H2O(g)
 CO2(g)£«H2(g)(Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦)ÖŠ£¬øıäĻĀĮŠĢõ¼ž£¬²»ÄÜŹ¹vÕżŌö“óµÄŹĒ
CO2(g)£«H2(g)(Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦)ÖŠ£¬øıäĻĀĮŠĢõ¼ž£¬²»ÄÜŹ¹vÕżŌö“óµÄŹĒ
(””””)”£
A£®ÉżøßĪĀ¶Č B£®½µµĶĪĀ¶Č
C£®Ź¹ÓĆ“ß»Æ¼Į D£®Ōö“óCOÅضČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬·“Ó¦2SO2(g)£«O2(g)  2SO3(g)£¬“ļµ½Ę½ŗāŹ±£¬n(SO2)”Ćn(O2)”Ćn(SO3)£½2”Ć3”Ć4”£ĖõŠ”Ģå»ż£¬·“Ó¦ŌŁ“Ī“ļµ½Ę½ŗāŹ±£¬n(O2)£½0.8 mol£¬n(SO3)£½1.4 mol£¬“ĖŹ±SO2µÄĪļÖŹµÄĮæÓ¦ŹĒ
2SO3(g)£¬“ļµ½Ę½ŗāŹ±£¬n(SO2)”Ćn(O2)”Ćn(SO3)£½2”Ć3”Ć4”£ĖõŠ”Ģå»ż£¬·“Ó¦ŌŁ“Ī“ļµ½Ę½ŗāŹ±£¬n(O2)£½0.8 mol£¬n(SO3)£½1.4 mol£¬“ĖŹ±SO2µÄĪļÖŹµÄĮæÓ¦ŹĒ
(””””)”£
A£®0.4 mol B£®0.6 mol C£®0.8 mol D£®1.2 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ¹ŲÓŚSO2µÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ(””””)
A£®SO2¼ČæÉŅŌŹĒŗ¬ĮņĪļÖŹµÄŃõ»Æ²śĪļ£¬ÓÖæÉŅŌŹĒŗ¬ĮņĪļÖŹµÄ»¹Ō²śĪļ
B£®SO2ÓėĖ®·“Ӧɜ³ÉĮņĖį
C£®“óĘųÖŠSO2µÄÖ÷ŅŖĄ“Ō“ŹĒĘū³µÅųöµÄĪ²Ęų
D£®SO2¾ßÓŠĘư׊Ō£¬Ņņ¶ųæÉŅŌŹ¹ŹÆČļŹŌŅŗĶŹÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
BPOŹĒŹ¹Ćę·ŪŌö°×µÄŅ»ÖÖĢķ¼Ó¼Į”£·Ö×Ó½į¹¹ÖŠÓŠĮ½øö±½»·µÄBPOÖ»ŗ¬ÓŠC”¢H”¢OČżÖÖŌŖĖŲ£¬ĘäĻą¶Ō·Ö×ÓÖŹĮæ²»³¬¹ż250£¬ŃõŌŖĖŲµÄÖŹĮæ·ÖŹżŌ¼ĪŖ26.45%”£BPOæÉĶعżĻĀĮŠ·½·ØµĆµ½(·“Ó¦Ģõ¼žĀŌ)£ŗ
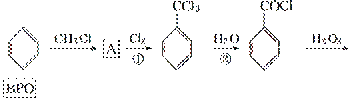
(1)Š“³öAµÄ½į¹¹¼ņŹ½____________£¬·“Ó¦¢ŁµÄ·“Ó¦ĄąŠĶĪŖ__________”£
(2)Š“³ö·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½________________________________________________”£
(3)BPO¾ßÓŠ¶Ō³ĘµÄ·Ö×Ó½į¹¹ĒŅ·Ö×ÓÖŠŗ¬ÓŠ¹żŃõ¼ü(”ŖO”ŖO”Ŗ)£¬µ«²»ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ŹŌŠ“³öBPOµÄ½į¹¹¼ņŹ½__________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com