
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
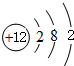 ,故答案为:
,故答案为: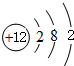 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
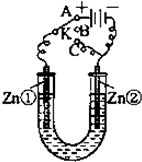 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D四种短周期元素.在元素周期表中的相对位置如下图所示,其中B元素的氧化物是形成酸雨的主要成分.请填空:
已知A、B、C、D四种短周期元素.在元素周期表中的相对位置如下图所示,其中B元素的氧化物是形成酸雨的主要成分.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24g | B、18g |
| C、21.6g | D、14.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类不相同 |
| B、常温下1mol?L-1的CH3COOH溶液与1mol?L-1的NaOH溶液等体积混合,所得混合液中[Na+]>[CH3COO-]>[H+]>[OH-] |
| C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,[NH4+]前者小于后者 |
| D、常温下,某溶液中由水电离出的[H+]为1.0×10-5mol?L-1,则此溶液可能是盐酸,也可能是NH4Cl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com