


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源:不详 题型:填空题
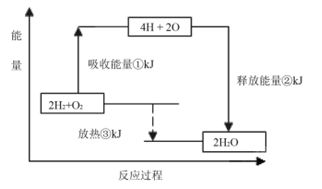
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=+567.85kJ·mol-1 |
| B.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85kJ·mol-1 |
| C.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=+567.85kJ·mol-1 |
| D.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=-567.85kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
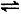 2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是
2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是| A.Q乙=0.5Q甲 | B.Q乙< 0.5Q甲 | C.Q乙<Q甲=197kJ | D.Q甲=Q乙<197kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.+1638KJ·mol–1 | B.–1638KJ·mol–1 | C.+126KJ·mol–1 | D.–126KJ·mol–1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
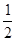 O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1| A.-488.3 kJ·mol-1 | B.-244.15 kJ·mol-1 | C.+488.3 kJ·mol-1 | D.+244.15 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com