
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
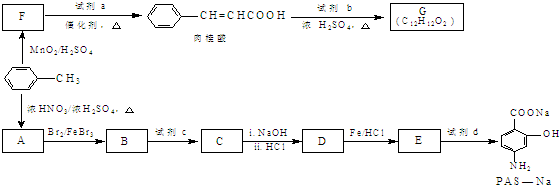
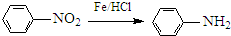
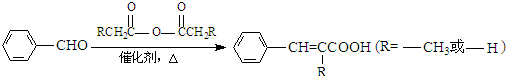
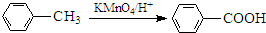
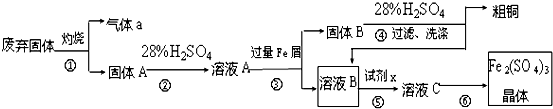
 生成A的反应类型是
生成A的反应类型是查看答案和解析>>
科目:高中化学 来源: 题型:
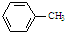
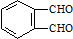 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2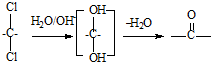 的反应得到
的反应得到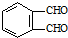 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 操作 |
| A. | 配制100 mL 1.0 mol?L-1 CuSO4溶液 | 将25 g CuSO4?5H2O溶于100 mL蒸馏水中 |
| B. | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C. | 在溶液中将MnO4- 完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D. | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解 |
| D、向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
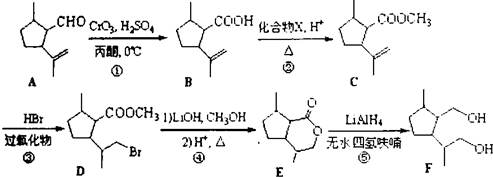
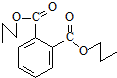
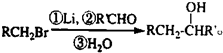 化合物
化合物  是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以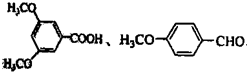 和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2
和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
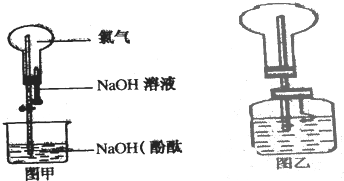 某研究性学习小组在做Cl2的喷泉实验时(图甲),发现含有酚酞的NaOHaq喷入烧瓶后,溶液的红色褪去,甲、乙两同学对此现象分别做了如下推测:
某研究性学习小组在做Cl2的喷泉实验时(图甲),发现含有酚酞的NaOHaq喷入烧瓶后,溶液的红色褪去,甲、乙两同学对此现象分别做了如下推测:查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A、前10 min内反应的平均速率为v(C)=0.050 mol?L-1?min-1 |
| B、保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol |
| C、若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积,则A的转化率减小 |
| D、温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com