解:(1)图甲是胶头滴管,其作用是用于取少量液体,故答案为:胶头滴管;用于取少量液体;
(2)量筒的最小刻度在下方,每一小格的值为:
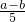
,所以图示表示的读数应为:(b+
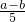
×3)ml,故答案为:(b+
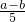
×3)ml;
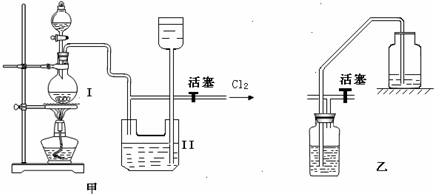
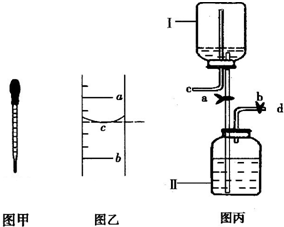
(3)①A、打开止水夹a、b.气体从d管导入,储存在下面的瓶子里,水被压入上瓶,这是利用排水集气法来收集气体,故A正确;
B、取用气体时,由于c是与外界通着,打开止水夹a、b,靠水的重力即可方便地将气体排出,故B正确;
C、由于此装置工作原理是通过重力作用,所以c必须是与外界通着,故不需要安装止水夹;故C错误;
D、下边瓶中放入锌粒,上边的瓶中放入稀盐酸即能完成实验室制取氢气的发生装置,故D正确.
故选:C.
②要从该储好气的装置中取用气体,正确操作是打开止水夹a、b,靠水的重力即可方便地将气体排出,故答案为:打开止水夹a、b,靠水的重力即可方便地将气体排出;
分析:(1)图甲是胶头滴管,其作用是滴加液体;
(2)首先明确量筒的最小刻度在下方,然后计算出每一小格的刻度值,最后读出读数;
(3)①A、利用排水集气法来收集气体;
B、取用气体时,靠水的重力即可方便地将气体排出;
C、由于此装置工作原理是通过重力作用,所以c必须是与外界通着;
D、下边瓶中放入石灰石,上边的瓶中放入稀盐酸即能完成实验室制取氢气的发生装置;
②取用气体时,靠水的重力即可方便地将气体排出;
点评:本题主要考查了实验装置的设计,掌握原理是解题的关键,难度不大,根据课本知识即可完成.

 (1)图甲是实验室常用的一种仪器,其名称是______;其主要用途是______.
(1)图甲是实验室常用的一种仪器,其名称是______;其主要用途是______.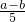 ,所以图示表示的读数应为:(b+
,所以图示表示的读数应为:(b+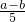 ×3)ml,故答案为:(b+
×3)ml,故答案为:(b+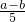 ×3)ml;
×3)ml;

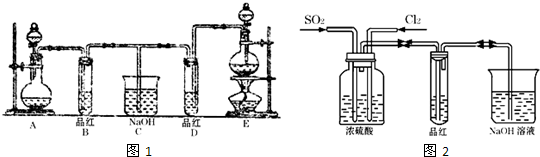
 氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).
氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).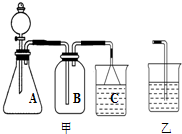 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题: