
| A. | 13:8 | B. | 8:13 | C. | 16:9 | D. | 9:16 |
科目:高中化学 来源: 题型:选择题
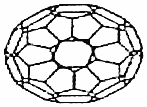
| A. | C60的摩尔质量是720 g•moL-1 | |
| B. | 1 mol C60完全燃烧生成22.4 L CO2 | |
| C. | C60属于有机化合物 | |
| D. | C60的结构与金刚石一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 配制100mL 1.0mol?L-1的氯化钠溶液过程中,
配制100mL 1.0mol?L-1的氯化钠溶液过程中,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- | |
| D. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 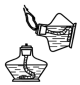 点燃酒精灯 | B. | 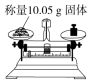 称取氯化钠 | C. | 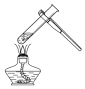 液体加热 | D. |  量取9.5mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
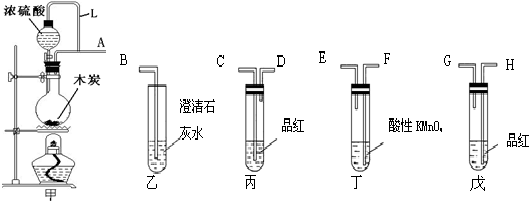
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
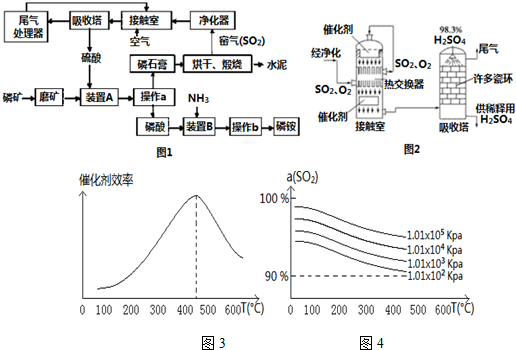
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com