
| Ksp(AgCl) |
| c(Cl-) |
| 1.8×10-8 |
| 1.0×10-4 |
|
|
| Ksp(AgCl) |
| c(Cl-) |
| 1.8×10-8 |
| 1.0×10-4 |
|
|
| Ksp(AgCl) |
| c(Cl-) |
| 1.8×10-10 |
| 1×10-5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、硝酸铵可以用作化肥 |
| B、Fe2O3常用于制造红色油漆和涂料 |
| C、Si可用于制造太阳能电池 |
| D、98%乙醇溶液可用于医疗消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠与氯化铜溶液:2OH-+Cu2+=Cu(OH)2↓ |
| B、石灰石与盐酸:CO32-+2H+=CO2↑+H2O |
| C、氯气与碘化钾溶液:Cl2+2I-=2I+2Cl- |
| D、用氢氧化钠溶液除去铝表面的氧化膜:AlO+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
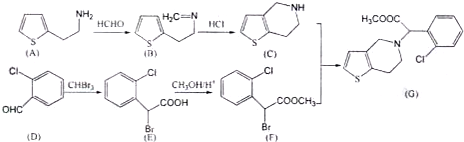
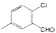 )是D的一种同系物,在H的同分异构体中,同时满足下列条件的物质的结构简式为
)是D的一种同系物,在H的同分异构体中,同时满足下列条件的物质的结构简式为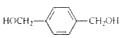 为起始原料,其他试剂任选,设计制备化合物
为起始原料,其他试剂任选,设计制备化合物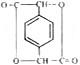 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
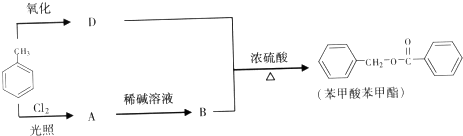
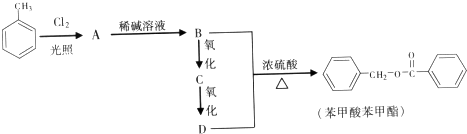
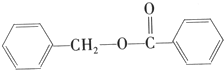 的化学方程式为
的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 水解 |
| 乳酸菌 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加成反应→消去反应→取代反应 |
| B、消去反应→加成反应→水解反应 |
| C、取代反应→消去反应→加成反应 |
| D、消去反应→加成反应→消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com