
含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题。
 (1)请写出通入SO2时发生的离子反应:______________________________________。
(1)请写出通入SO2时发生的离子反应:______________________________________。
(2)该流程中干化污泥的主要成分为 (填化学式),写出加入铝粒时发生反应的化学方程式____________________________________。
(3)还原Cr2O 也可以使用其他还原剂,如电解还原法就是使用Fe电极电解酸性含铬废水,电解时产生的Fe2+作还原剂还原Cr2O
也可以使用其他还原剂,如电解还原法就是使用Fe电极电解酸性含铬废水,电解时产生的Fe2+作还原剂还原Cr2O 变为Cr3+,该反应的离子方程式为 。
变为Cr3+,该反应的离子方程式为 。
Ⅱ.含铬废渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成分。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其他成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
(4)铬渣烧结炼铁法中煤粉的作用是 。(写两点)
(5)碱性溶液还原法:直接在碱性铬渣溶液中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。请配平碱性溶液还原法中发生的离子反应:
 Cr2O
Cr2O +
+ S2-+
S2-+ H2O===
H2O=== Cr(OH)3↓+
Cr(OH)3↓+ S2O
S2O +
+ OH-
OH-
(6)若用碱性溶液还原法处理1L PH=9的含铬废水,处理后溶液的PH变为10,则理论上在此过程中处理掉的Cr2O 的物质的量约为 mol。
的物质的量约为 mol。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
下列各项表述中正确的是 ( )
A.氯化钠的电子式:
B.106 g的乙醇和丙醇(化学式为C3H8O)混合液完全燃烧生成的CO2为112 L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为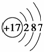
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分
异构体的反应是 ( )
A.异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.邻羟基苯甲酸与NaHCO3溶液反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.2-氯丁烷与NaOH乙醇溶液共热发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
 A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.丙图装置可制得金属锰,用同样的装置可制得金属铬
D.丁图验证NaHCO3和Na2CO3热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质性质的基本程序是一个系统过程,其基本程序一般分为四个过程。下列是研究物质性质基本程序的第一步的是
A.预测物质的性质 B.观察物质的外观性质
C.进行实验和观察 D.作出相关的解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是 ( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称量
D.过滤时,慢慢地将液体直接倒入过滤器中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com