
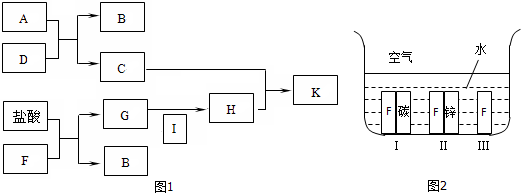
分析 C的焰色反应呈黄色,应含有Na元素,则A应为Na,D是最常见的溶剂,应为H2O,A和D反应生成NaOH和H2,则C为NaOH,B为H2,I为黄绿色气体,应为Cl2,K是红褐色固体,应为Fe(OH)3,则H为FeCl3,G为FeCl2,F为Fe,金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护.
解答 解:C的焰色反应呈黄色,应含有Na元素,则A应为Na,D是最常见的溶剂,应为H2O,A和D反应生成NaOH和H2,则C为NaOH,B为H2,I为黄绿色气体,应为Cl2,K是红褐色固体,应为Fe(OH)3,则H为FeCl3,G为FeCl2,F为Fe,
(1)由以上分析可知F为Fe,原子核外有4个电子层,最外层电子数为2,应位于周期表第四周期、ⅤⅢ族,
故答案为:第四周期,ⅤⅢ族;
(2)D为H2O,A为Na,二者反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,G为FeCl2,具有还原性,可被Cl2氧化生成FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Na+2H2O=2Na++2OH-+H2↑; 2Fe2++Cl2=2Fe3++2Cl-;
(3)H为FeCl3,含有Fe3+,加入KSCN溶液变红色,
故答案为:变红色;
(4)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护,则该金属被腐蚀的速率由快到慢的顺序是Ⅰ>Ⅲ>Ⅱ,故答案为:Ⅰ>Ⅲ>Ⅱ;
点评 本题考查元素化合物的推断,难度不大,可根据物质的特殊颜色或特殊化学反应推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,学习中注意把握金属腐蚀快慢的比较.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:填空题
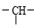 则其结构简式为:CH3CH(CH3)CH2CH2CH3,CH3CH2CH(CH3)CH2CH3.
则其结构简式为:CH3CH(CH3)CH2CH2CH3,CH3CH2CH(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,11.2LHF中含有H-F键的数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com