
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使红色石蕊试纸变蓝,也能使淀粉碘化钾试纸变蓝 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与过量锌粉反应的离子方程式为:Zn+2Fe3+═2Fe2++Zn2+ |
分析 A.NH4Fe(SO4)2在溶液中电离出铵根离子、铁离子和硫酸根离子,H+、Mg2+、NO3-、Cl-四种离子之间不反应,都不与铵根离子、铁离子和硫酸根离子反应;
B.铵根离子和铁离子水解都生成氢离子,铁离子与碘离子发生氧化还原反应;
C.该溶液和足量Ba(OH)2溶液反应时,硫酸铁铵与氢氧化钡的物质的量之比为1:2,据此写出反应的离子方程式;
D.该溶液与过量锌粉反应,铵根离子和铁离子水解都生成氢离子,酸与锌反应生成氢气,锌和铁离子发生氧化还原反应.
解答 解:A.H+、Mg2+、NO3-、Cl-之间不反应,都不与NH4Fe(SO4)2发生反应,在溶液中能够大量共存,故A正确;
B.铁离子与碘离子发生氧化还原反应生成碘单质和亚铁离子,离子方程式为:2Fe3++2I-═2Fe2++I2,所以能使淀粉碘化钾试纸变蓝,铵根离子和铁离子水解都生成氢离子,溶液呈酸性,检验酸性溶液应用蓝色石蕊试纸,故B错误;
C.铵根离子反应生成氨水、铁离子与碱反应生成氢氧化铁沉淀,反应的离子方程式为:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+Fe(OH)3↓,故C错误;
D.NH4Fe(SO4)2在溶液中电离出铵根离子、铁离子和硫酸根离子,铵根离子和铁离子水解都生成氢离子,酸与锌反应生成氢气,锌和铁离子发生氧化还原反应,所以该溶液与过量锌粉反应除生成亚铁离子、和锌离子,还应有氢气生成,故D错误;
故选A.
点评 本题考查了离子共存的判断、离子方程式的书写及盐的水解原理及其影响等知识,题目难度中等,试题知识点较多,充分考查了学生的分析能力及灵活应用基础知识的能力,注意熟练掌握离子方程式的书写原则,明确判断离子方程式正误的常用方法.


科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| B. | 在Cl2制备实验中,用饱和食盐水除去Cl2中的HCl气体,用NaOH溶液吸收尾气 | |
| C. | 除去CO2气体中混有的少量HCl,可以将气体通入饱和NaHCO3溶液中 | |
| D. | H2在Cl2中燃烧火焰呈淡蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
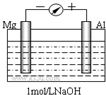 实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
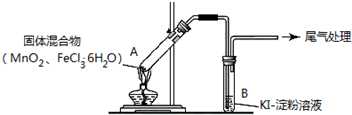
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B 间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B 中KI淀粉溶液替换为NaBr 溶液;检验 Fe 2+ | B中溶液呈浅橙红色;未检出Fe 2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 干冰熔化或升华时,CO2分子内的C=O键会被破坏 | |
| B. | 乙炔与氢气反应会变成乙烯,碳原子的杂化类型由sp变为sp2 | |
| C. | 物质的状态变化,只需克服分子间作用力 | |
| D. | 分子中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用溴水鉴别乙烯和SO2 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、乙烯和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
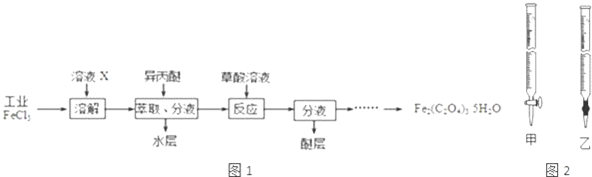
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: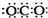 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 甲烷的结构简式:CH4 | D. | 乙烯分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是轴对称的,π键是镜像对称的 | |
| B. | σ键是“头碰头”式重叠,π键是“肩并肩”式重叠 | |
| C. | σ键不能断裂,π键容易断裂 | |
| D. | H原子只能形成σ键,O原子可以形成σ键和π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com