
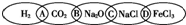 对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.如图为一“链状连环”图案,图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.如图为一“链状连环”图案,图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13C和14C属于同一种元素,它们互为同位素 |
| B、1H和2H是不同的粒子,但它们的质子数相等 |
| C、14C 和14N的质量数相等,它们互为同位素 |
| D、6Li和7Li的电子数相等,但中子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 21.98 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 22.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com