
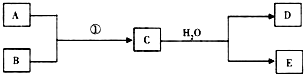
 (1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.分析 (1)若条件①为点燃,目前60%的B都是从海水中提取的,则B是Mg,气体D可以使湿润的红色石蕊试纸变蓝,则D是NH3,C和水反应生成氨气和E,根据元素守恒知,A中含有氮元素,Mg和氮气能发生生成氮化镁,所以A是氮气,氮化镁和水反应生成氨气和氢氧化镁,据此写出反应方程式;
碱性氨气燃料电池中,负极上氨气失电子发生氧化反应;
(2)a、若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,硫化氢是二元酸,和等物质的量的氢氧化钠反应生成硫氢化钠,据此写出反应方程式;
b、A、混合溶液呈中性,则c(H+)=c(HO-),根据电荷守恒得c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42- )+c(HO-);
B、草酸氢钠(NaHC204)水溶液呈酸性,草酸氢根离子具有较强还原性,能被强氧化性物质氧化;
C、结合物料守恒来分析,n(N)=n(C)守恒列式分析判断;
D、草酸具有还原性,酸性高锰酸钾具有强氧化性,所以醋酸能被酸性高锰酸钾氧化生成二氧化碳;
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和浓硝酸反应生成硝酸铁、二氧化氮和水;利用盖斯定律计算.
解答 解:(1)若条件①为点燃,目前60%的B都是从海水中提取的,则B是Mg,气体D可以使湿润的红色石蕊试纸变蓝,则D是NH3,C和水反应生成氨气和E,根据元素守恒知,A中含有氮元素,Mg和氮气能发生生成氮化镁,所以A是氮气,氮化镁和水反应生成氨气和氢氧化镁,所以其反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
碱性氨气燃料电池中,负极上氨气失电子发生氧化反应,电极反应式为:2NH3+6OH--6e-=N2↑+6H2O,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;2NH3+6OH--6e-=N2↑+6H2O;
(2)a、若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,硫化氢是二元酸,和等物质的量的氢氧化钠反应生成硫氢化钠,所以离子反应方程式为:H2S+OH-=HS-+H2O,故答案为:H2S+OH-=HS-+H2O;
b、A.混合溶液呈中性,则c(H+)=c(HO-),根据电荷守恒得c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42- )+c(HO-),所以得c(Na+)=c(HC2O4-)+2c(C2O42- ),故A错误;
B.草酸氢根离子具有还原性,能被次氯酸钠氧化生成二氧化碳,故B错误;
C.根据物料守恒得,草酸铵溶液中为:c(NH4+)+c(NH3•H2O)=2c(H2C2O4)+2c(HC2O4-)+2c(C2O42- ),故C错误;
D.草酸具有还原性,酸性高锰酸钾具有强氧化性,所以醋酸能被酸性高锰酸钾氧化生成二氧化碳,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故D正确;
故答案为:D;
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,过量Fe粉和稀硝酸反应生成硝酸铁、NO和水,反应方程式为:3Fe+8HNO3(稀)$\frac{\underline{\;\;△\;\;}}{\;}$3Fe(NO3)2+2NO↑+4H2O;
常温下A与B反应生成1molC的焓变为-57.07kJ/mol,其热化学反应方程式为:2NO+O2=2NO2△H=-114.14kJ/mol①,
1molC与H2O反应生成气体D和E溶液的焓变为-46kJ/mol,其热化学反应方程式为3NO2+H2O=2HNO3+NO△H=-138kJ/mol②,
将方程式①×3+②×2得4NO(g)+3O2(g)+2H2O(l)=4HNO3(aq)△H=(-114.14kJ/mol)×3+(-138kJ/mol)×2=618.42kJ/mol,
故答案为:3Fe+8HNO3(稀)$\frac{\underline{\;\;△\;\;}}{\;}$3Fe(NO3)2+2NO↑+4H2O;4NO(g)+3O2(g)+2H2O(l)=4HNO3(aq)△H=-618.42kJ/mol.
点评 本题考查元素化合物的性质,正确推断物质是解本题关键,明确物质的特殊性质即可解答,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都等于零 | B. | SO2、O2、SO3的浓度相等 | ||
| C. | SO2、O2、SO3在容器中共存 | D. | SO2、O2、SO3的浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )
如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )| A. | X:SO2,Y:饱和NaHCO3溶液 | B. | X:Cl2,Y:饱和Na2SO3溶液 | ||
| C. | X:HCl,Y:饱和NaHSO3溶液 | D. | X:CO2,Y:饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com