
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v=_________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】(1)K=![]() (1分)放热(1分)
(1分)放热(1分)
(2)b(1分) 1.5×10-3mol/(L·s)(2分) (3)b c (2分) (4)c(1分)
【解析】
本题考查化学平衡状态的判断、化学平衡移动、化学平衡常数等。(1)根据反应方程式结合平衡常数定义可得:K=![]() ;K300℃>K350℃,即升高温度,平衡向逆反应方向移动,则该反应为放热反应;(2)NO2为生成物,随着反应的进行,NO2的浓度逐渐增大,NO的起始浓度为0.01mol/L,因反应为可逆反应,NO不可能完全转化为NO2,故图中表示NO2的变化的曲线是b;0~2s内O2的平均速率:
;K300℃>K350℃,即升高温度,平衡向逆反应方向移动,则该反应为放热反应;(2)NO2为生成物,随着反应的进行,NO2的浓度逐渐增大,NO的起始浓度为0.01mol/L,因反应为可逆反应,NO不可能完全转化为NO2,故图中表示NO2的变化的曲线是b;0~2s内O2的平均速率: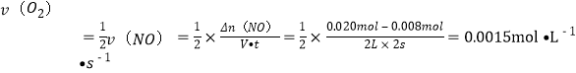 ;(3)A中未指明反应速率的方向,A项错误;该反应是反应前后气体体积发生变化的反应,所以容器中的压强不再发生变化,说明反应已经达到平衡,B项正确;不同物质正、逆反应的速率之比等于化学计量数之比,说明反应已经达到平衡,C项正确;该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量不变,所以容器内气体的密度不变,当容器中气体的密度不再发生变化时,不能表明达到化学平衡状态,D项错误。
;(3)A中未指明反应速率的方向,A项错误;该反应是反应前后气体体积发生变化的反应,所以容器中的压强不再发生变化,说明反应已经达到平衡,B项正确;不同物质正、逆反应的速率之比等于化学计量数之比,说明反应已经达到平衡,C项正确;该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量不变,所以容器内气体的密度不变,当容器中气体的密度不再发生变化时,不能表明达到化学平衡状态,D项错误。


科目:高中化学 来源: 题型:
【题目】2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶液可制得“84消毒液”,用电子式表示“84消毒液”的有效成分是__________。
(2)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,也可用于自来水的杀菌消毒。工业上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
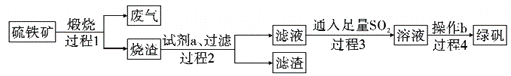
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol。下列说法正确的是
2NH3(g) △H=-92.4 kJ/mol。下列说法正确的是
A. 将1.0 mol N2、3.0 mol H2置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B. 上述反应达平衡后,若容积不变,再充入1.0 mol氦气,N2的转化率提高
C. 上述反应在达到平衡后,缩小容积增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
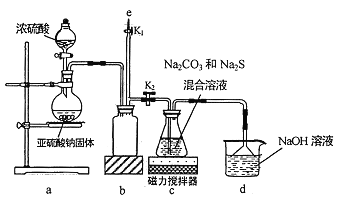
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是( )

A.气态氢化物的酸性:R>T>Q
B.气态氢化物的还原性:X>T
C.R 与 Q 的电子数相差 16
D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
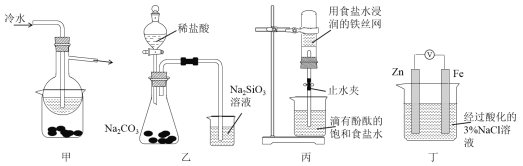
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是
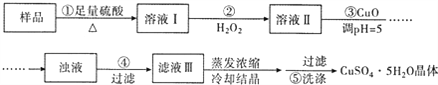
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com