
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式应为 。
科目:高中化学 来源: 题型:阅读理解
(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
① 甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101![]() 时:
时:![]()
![]()
则在25℃,101![]() 时:
时:![]() .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,![]() ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用![]() 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
![]() 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol![]() 和3mol
和3mol![]() ,反应过程中测得
,反应过程中测得![]() 和
和![]() (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入![]() C.再充入
C.再充入![]()
D.将![]() (g)从体系中分离 E.充入He(g),使体系压强增大
(g)从体系中分离 E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源:2012届山东省莱州一中高三第二次质量检测化学试卷 题型:填空题
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101 时:
时:

则在25℃,101 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为: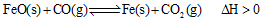 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的 平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时, ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用 来生产燃料甲醇
来生产燃料甲醇 ,有关反应为:
,有关反应为: 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使 增大的是
增大的是  (填符号)。
(填符号)。
| A.升高温度 |
B.再充入 |
C.再充入 |
D.将 (g)从体系中分离 (g)从体系中分离 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三下学期假期学习效果检测考试化学试卷 题型:填空题
(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

① 甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第二次质量检测化学试卷 题型:填空题
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101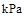 时:
时:

则在25℃,101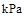 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时, ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
③目前工业上可用 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入 C.再充入
C.再充入
D.将 (g)从体系中分离
E.充入He(g),使体系压强增大
(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com