
分析 (1)①卤代烃在碱性条件下完全水解;
②中和NaOH,使溶液呈酸性,有利于卤化银的沉淀;
(2)若生成的沉淀为淡黄色,则该沉淀为AgBr;
(3)CH3CH2Br在碱性条件下水解为乙醇和NaBr.
解答 解:(1)①卤代烃在碱性条件下完全水解,所以加入NaOH的目的是中和卤代烃水解产生的卤化氢,使水解完全,
故答案为:促进水解的进行;
②反应后的溶液中由剩余的NaOH,加入硝酸中和NaOH,使溶液呈酸性,有利于卤化银的沉淀,
故答案为:中和NaOH;
(2)若生成的沉淀为淡黄色,则该沉淀为AgBr,所以该卤代烃中的卤原子是Br,
故答案为:Br;
(3)CH3CH2Br在碱性条件下水解为乙醇和NaBr,故化学方程式为:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr.
点评 本题考查了卤代烃分子式的中卤素离子的检验方法,较基础,注意检验之前,先中和多余的碱,使溶液呈碱性.


科目:高中化学 来源: 题型:解答题
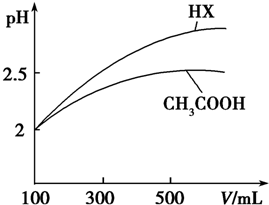
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取3种溶液,滴加紫色石蕊溶液 | 溶液会变红的是①③ | |
| 2 | 用足量的乙酸溶液浸泡碳酸钙 | 有关反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑ | |
| 3 | 将CO2通入苯酚钠溶液中 | 有关反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+NHCO3- | |
| 结论:3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②(填序号) | |||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
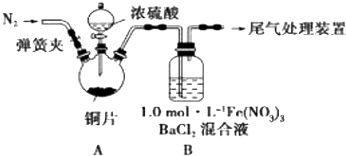
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 →
→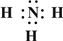 ,B的结构式为
,B的结构式为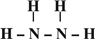 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com