
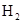 和
和 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定 的变化,5S时测定
的变化,5S时测定 =0.0080mol/L并保持不变。H2+I2(g)
=0.0080mol/L并保持不变。H2+I2(g) 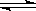 2HI(g)
2HI(g) = ;
= ; (2) 0.25 (3) 80%
(2) 0.25 (3) 80% 。
。 =0.0080mol/L,则消耗碘分子的浓度为0.01mol/L-0.008mol/L=0.002mol/L,生成HI是0.004mol/L,所以反应的平衡常数
=0.0080mol/L,则消耗碘分子的浓度为0.01mol/L-0.008mol/L=0.002mol/L,生成HI是0.004mol/L,所以反应的平衡常数 =
=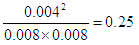
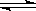 H2 + I2(g)
H2 + I2(g)


科目:高中化学 来源:不详 题型:单选题
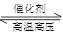 2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa—50 MPa,温度:500 ℃左右,催化剂:铁触媒。下列有关合成氨工业的叙述不正确的是
2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa—50 MPa,温度:500 ℃左右,催化剂:铁触媒。下列有关合成氨工业的叙述不正确的是| A.使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B.工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C.上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D.温度升高,不利于氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数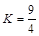 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:| 起始浓度(mol/L) | 甲 | 乙 | 丙 | 丁 |
| c(H2) | 0.01 | 0.02 | 0.02 | 0.005 |
| c(CO2) | 0.01 | 0.01 | 0.02 | 0.005 |
| c(H2O) | 0 | 0 | 0 | 0.005 |
| c(CO) | 0 | 0 | 0 | 0.005 |
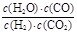 值最小
值最小查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
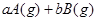

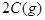
 ): 1.5 1.0 0
): 1.5 1.0 0 ): 0.9 0.8 0.4
): 0.9 0.8 0.4查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4在一定体积中达平衡的标志是( )
N2O4在一定体积中达平衡的标志是( )| A.混合气颜色不随时间的变化 |
| B.数值上v(NO2生成)=2v(N2O4消耗) |
| C.单位时间内反应物减少的分子数等于生成物增加的分子数 |
| D.密度不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为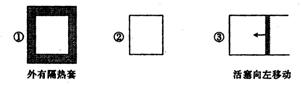
| A.③②① | B.②①③ | C.①②③ | D.③①② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HSO3-+OH-水解平衡的事实是 _(填序号)。
HSO3-+OH-水解平衡的事实是 _(填序号)。
 2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:| A.混合气体的密度不变 |
| B.容器中的压强不再变化 |
| C.生成D的反应速率是生成B的反应速率的2倍 |
| D.单位时间内生成3molA,同时生成1molB |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com