
【题目】取1 mL 0.1 mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):

下列说法不正确的是
A.实验①白色沉淀是难溶的AgClB.若按②①顺序实验,能看到白色沉淀
C.若按①③顺序实验,能看到黑色沉淀D.由实验②说明 AgI 比 AgCl 更难溶
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏伽德罗常数的值,下列说法正确的是( )
表示阿伏伽德罗常数的值,下列说法正确的是( )
A.![]() 氢气中含有氢原子的数目为
氢气中含有氢原子的数目为![]()
B.标准状况下,![]() 苯中含有苯分子的数目为
苯中含有苯分子的数目为![]()
C.![]() 溶液中含有氯离子的数目为
溶液中含有氯离子的数目为![]()
D.![]() 与足量水反应,转移的电子数为
与足量水反应,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工业流程如图。已知:①草酸钴晶体难溶于水;②RH为有机物(难电离)。
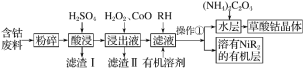
(1)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式:_________________。
(2)加入氧化钴的目的是_______________________________。
(3)草酸钴晶体分解后可以得到多种钴的氧化物(其中Co的化合价为+2、+3),取一定量钴的氧化物,用280mL5mol·L-1盐酸恰好完全溶解,并得到CoCl2溶液和2.24L(标准状况)黄绿色气体,由此可确定该钴氧化物中Co、O的物质的量之比为________。
(4)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-),测定溶液中![]() 的浓度,写出此反应的离子方程式:_______________________________________;KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果________(填“偏高”“偏低”或“无影响”)。
的浓度,写出此反应的离子方程式:_______________________________________;KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
①CH4(g)=C(s)+2H2(g) ΔH>0
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。

同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①![]()
![]() ,②
,②![]()
![]() 。下列结论正确的是
。下列结论正确的是
A.碳的燃烧热大于110.5 kJ·mol1
B.①的反应热为221 kJ·mol1
C.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
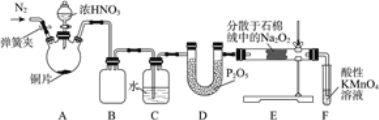
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据工业上合成氨的反应为:![]() ,判断下列错误的是
,判断下列错误的是
A | B | C | D |
|
|
|
|
根据图中a点数据计算 | 表示从通入原料开始,随温度不断升高, | 向绝热恒容器中通入 | 图中 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com