
【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行者广泛研究。回答:
(1)某课题组实现了在常湿常压下,以氮气和液态水为原料制备氨气同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(s) | H20(1) |
△H/ kJ·mo1-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为催化剂,据到示判断,负极反应的催化剂为___(填“Q”或“R”);正极的电极反应式为_______________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+ 6H2O(g)△H=-126kJ/mol
2N2(g)+ 6H2O(g)△H=-126kJ/mol
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
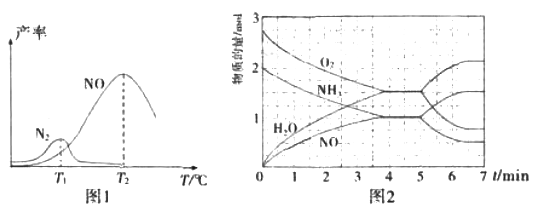
①催化氧化步骤中,最适宜的温度为____(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____。
③高于T2℃时,NO的产率降低的可能原因为_____(填选项字母)
A.催化剂活性降低 B.平衡常数减小 C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充入2molNH3和2.75mo1O2,发生反应I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。T2℃时,该反应的平衡常数K=_____;5min时,改变了某一外界条件,所改变的条件可能为__________。
【答案】 2N2(g)+6H2O(1)=3O2(g)+4NH3(g) △H=+1268kJ/mol Q N2+6H++6e-=2NH3 T2 温度较低时,反应速率慢,同时部分反应物生成N2 AB 0.075 升高温度或缩小容器容积
【解析】(1)由①N2+3H2=2NH3(g)此时热效应是(-46![]() )kJ/mol;②2H2(g)+O2(g)=2H2O(l)此时的热效应(-242
)kJ/mol;②2H2(g)+O2(g)=2H2O(l)此时的热效应(-242![]() )kJ/mol;①
)kJ/mol;①![]() 合成氨反应的热化学方程式为2N2(g)+6H2O(1)=3O2(g)+4NH3(g) △H=+1268kJ/mol
合成氨反应的热化学方程式为2N2(g)+6H2O(1)=3O2(g)+4NH3(g) △H=+1268kJ/mol
(2)根据原电池工作原理负极上失去电子,化合价升高,所以通氢气的一端为负极,根据装置图Q为催化剂,通氮气一极为正极,根据工作原理正极反应式为:N2+6H++6e-=2NH3。
(3) ①制硝酸用NH3和氧气反应生成NO,NO与O2反应生成NO2, NO2与水反应生成硝酸。T2时NO的产率最高,因此最适宜的温度是T2,
②低于T1℃时,反应速率慢,同时部分反应物转化为N2造成NO的产率较低。
③A.催化剂活性受温度影响,在一定温度时催化剂催化效率最高,超过此温度催化剂的活性降低了,故A正确; B.根据反应方程式生成NO是放热反应,升高温度,平衡逆向进行,平衡常数减小,故B正确;C.活化能的大小不影响平衡移动,故C错误; D.这里的水为气态,所以氨气溶于水是错的。答案:A B 。
根据图2,4min时达到平衡,c(NH3)=c(NO)=1/20mol.L-1,c(O2)=C(H2O)-1.5/20 mol.L-1,根据化学平衡表达式![]() 代入数据计算得K= 0.075
代入数据计算得K= 0.075
如果5min时氨气和氧气的物质的量增大,NO和H2O(g)的物质的量减小,说明改变这一条件平衡向逆反应方向移动,因为I.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol为放热反应,也是气体体积增大的反应,所以可能是升高温度或缩小容器容积。如果5min时氨气和氧气的物质的量减小,NO和H2O(g)的物质的量增大,说明改变这一条件平衡向正反应方向移动,所以可能是降低温度或增大容器容积了。
4NO(g)+6H2O(g)△H=-906kJ/mol为放热反应,也是气体体积增大的反应,所以可能是升高温度或缩小容器容积。如果5min时氨气和氧气的物质的量减小,NO和H2O(g)的物质的量增大,说明改变这一条件平衡向正反应方向移动,所以可能是降低温度或增大容器容积了。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】第四周期的元素,如:钛(22Ti)、铁(26Fe)、砷、硒、锌等及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为___________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
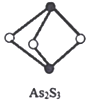
(4)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为____________,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________。SnCl4分子的空间构型为______________。
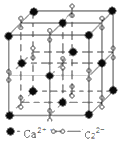
(5)高子化合物CaC2的一种晶体结构如图所示。该物质的电子式___________。一个晶胞含有的π键平均有___________个。
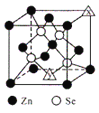
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.能生成碱的金属元素都在ⅠA族
B.原子序数为14的元素位于元素周期表的第3周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )

A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1H和2H是不同的核素,它们的质子数相同
B. 6Li和7Li的质子数相等,电子数也相等
C. 14C和14N的质量数相等,它们的中子数相等
D. 13C和14C属于同一种元素,它们的质量数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。下列说法正确的是

A. Li-CO2电池电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8mole-,生成3mol气体
C. 过程Ⅱ中电能转化为化学能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-=4Li++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有____________种;基态铜原子的价电子排布式为_______________,金属铜的晶体中,铜原子的堆积方式为________________。
(2)N和O中第一电离能较大的元素是___________;SO42-的空间构型是_______________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为______________,H2O2难溶于CCl4,其原因为__________________。
(4)PM2.5富含大量的有毒、有害物质,如NO、CH3COOONO2(PAN)等。1molPAN中含σ键数目为__________;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________________。
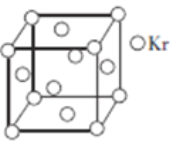
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相邻的Kr原子有m个,晶胞中所含Kr原子有n个,则m/n=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)=2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,容器内的压强是起始时的 ![]()
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol·L-1·min-l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com