
| A. | 4NH3+5O2═4NO+6H2O | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2NaHCO3═Na2CO3+H2O+CO2 | D. | Cl2+2NaBr═2NaCl+Br2 |
分析 有化合价变化的反应为氧化还原反应;
四大基本反应类型包括化合反应、分解反应、复分解反应和置换反应.
两种或多种物质反应生成一种物质的反应为化合反应;
一种物质反应生成两种或两种以上的物质的反应为分解反应;
两种化合物相互交换成分生成另外两种化合物的反应为复分解反应;
一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应.据此分析.
解答 解:A、此有化合价变化,故为氧化还原反应;但不属于四大基本反应类型,故A正确;
B、此反应为氧化还原反应,但此反应为化合反应,故B错误;
C、此反应无化合价变化,故不是氧化还原反应,故C错误;
D、此反应是氧化还原反应,但此反应为置换反应,故D错误.
故选A.
点评 本题考查了氧化还原反应和四大基本反应类型,难度不大,应注意的是氧化还原反应的判断.


科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10 NA
C.在反应KIO3 + 6 HI = KI + 3 I2 + 3 H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
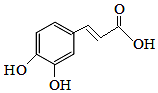
| A. | 能发生加聚反应 | |
| B. | 能与碳酸钠溶液反应 | |
| C. | 1 mol咖啡酸最多能与3 mol NaOH反应 | |
| D. | 1 mol咖啡酸最多能与 3 mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
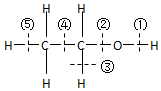
| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O;
+3H2O; 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com