
| A. | CO2通过Na2O2使其增重28 g 时,反应中转移的电子数为0.5NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则 Ba SO4饱和溶液中Ba2+数目为=1×10-5 NA | |
| C. | 标准状况下,22.4 L CH2Cl2中共价键的数目为4NA | |
| D. | 高温下,16.8g Fe与足量的水蒸气完全反应失去电子的数目为0.8NA |
分析 A.依据方程式:2CO2+2Na2O2=2Na2CO3+O2 ,消耗2mol二氧化碳转移2mol电子;
B.溶液体积未知;
C.标况下,二氯甲烷为液体;
D.求出铁的物质的量,然后根据铁与水蒸汽反应后变为+$\frac{8}{3}$价来分析;
解答 解:A.将CO2通过足量Na2O2中,过氧化钠增重的是CO的质量,即当1mol二氧化碳参与反应时,增重1molCO的质量即28g,故当固体质量增重28g时,参加反应的二氧化碳的物质的量为1mol,转移1mol电子,转移的电子数为NA,故A错误;
B.依据n=CV可知,溶液体积未知,无法计算钡离子数目,故B错误;
C.标况下,二氯甲烷为液体,不能使用气体摩尔体积,故C错误;
D.16.8g铁的物质的量为0.3mol,而铁与水蒸汽反应后变为+$\frac{8}{3}$价,故0.3mol铁失去0.8mol电子即0.8NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意铁与水反应生成产物及铁元素化合价,题目难度中等.


科目:高中化学 来源: 题型:选择题
 在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )
在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )| A. | Y一定呈气态 | |
| B. | T1大于T2 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当c(X):c(Y):c(Z)=1:2:2时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 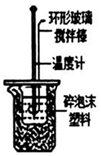 用图所示装置测定中和反应的反应热 | |
| B. |  用图所示装置在实验室制取少置乙烯 | |
| C. | 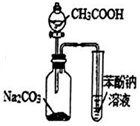 用图3所示装置证明碳酸酸性强于苯酚 | |
| D. | 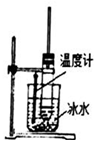 用图所示装置在实验室制取少量硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
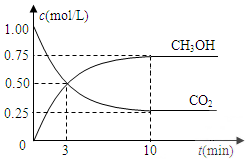 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用KMnO4溶液 | |
| C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低 | |
| D. | 将铜粉加1.0 mol•L-1Fe2(SO4)3溶液中,溶液变蓝,有黑色固体出现,说明金属铁比铜活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨 | 食盐 |
| B | 水玻璃 | KNO3晶体 | O2 | 纯碱(Na2CO3) |
| C | 空气 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4•5H2O | CaCl2 | 水银 | CaO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  该反应过程中的能量变化如图所示 | |
| B. | 该反应条件下,Al的还原性强于Fe | |
| C. | 反应中每生成1 mol Fe转移6×6.02×1023个电子 | |
| D. | 实验室进行该反应时常加入KClO3作催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com