
| A. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| B. | 在点燃易燃气体前,必须检验气体的纯度 | |
| C. | 为防止试管破裂,加热固体高锰酸钾制氧气时,试管口应略向下倾斜 | |
| D. | 萃取操作时,应选择可以和原溶剂不互溶的萃取剂 |
分析 A.汽油、煤油的密度小于水的密度;
B.可燃性气体如果纯度不足,点燃时容易发生爆炸;
C.试管口向上,这时水就会倒流到温度很高的试管底部,从而导致试管底部因骤冷而炸裂;
D.萃取剂与水互不相溶,以便分离.
解答 解:A.汽油、煤油的密度小于水的密度,汽油、煤油燃烧时,用自来水灭火时不但不能灭火,而且能扩大燃烧面积,故A错误;
B.点燃可燃性气体前需要检查纯度,避免因纯度不足导致气体爆炸发生危险,故B正确;
C.在固定试管时,试管口要稍稍向下倾斜,这是因为在加热的过程中药品高锰酸钾中含有的湿存水就会以水蒸气的形式,顺着氧气流,流向导管,当它遇到温度较低的试管口时,又会冷凝成水珠,如果试管口向上,这时水就会倒流到温度很高的试管底部,从而导致试管底部因骤冷而炸裂,故C正确;
D.萃取时,应使溶质更易溶于萃取剂,且萃取剂与水互不相溶,以便分离,故D正确.
故选A.
点评 本题考查了化学安全事故及处理方法,题目难度不大,注意掌握化学实验基本操作方法,明确常见的化学安全事故类型及正确的处理方法,以保证人身安全,降低国家财产损失.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.3g钠由原子变成离子时,失去的电子数目为0.2NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸分子含有相同的氧原子数 | |
| C. | 28g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
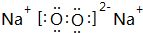 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中:K+、Mg2+、Fe2+、MnO4- | |
| B. | NaOH溶液中:Cu2+、NH4+、SO42-、CO32- | |
| C. | FeCl3溶液中:Al3+、Na+、I-、SO42- | |
| D. | NaClO溶液中:K+、SO42-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溴水加入苯中 | 溴水颜色变浅 | 苯与溴水发生取代反应 |
| B | 将SO2通入到Ba(NO3)2溶液中 | 有白色沉淀 | 沉淀成分为BaSO3 |
| C | 等体积、等PH的HA和HB两种溶液分别与足量的锌反应 | 相同时间内,HA酸产生的氢气多 | HA为强酸 |
| D | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置 | 下层液体呈紫色 | Br2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | Ba(OH)2溶液中滴加过量的NaHCO3溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| C. | 碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 澄清的石灰水中通过量的CO2:Ca(OH)2+CO2=CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化石燃料开采、加工过程常产生H2S废气,H2S的转化是资源利用和环境保护的重要课题.
化石燃料开采、加工过程常产生H2S废气,H2S的转化是资源利用和环境保护的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、CO32- | B. | NH4+、Na+、SO42- | C. | Mg2+、HCO3-、Cl- | D. | Ag+、Al3+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com