
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
科目:高中化学 来源: 题型:
【题目】【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种有机物,请回答下列问题:
A. | B. | C. |
D.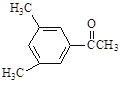 E.
E.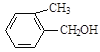 F.
F.![]()
(1)A物质中含有的官能团名称为_____________、______________。
(2)B的分子式为_________________。
(3)D的一氯代物最多有________________种。
(4)上述化合物中互为同分异构体的是_____;互为同系物的是____。(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂固化成膜后具有良好的耐磨性和绝缘性,下面是一种成膜性良好的醇酸树脂的合成路线,如下图所示:
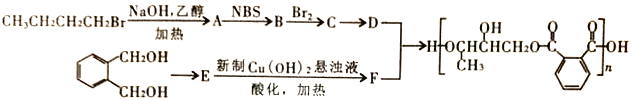
已知:①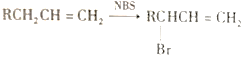 ②RCH=CH2
②RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
(1)A的化学名称为________________,E中官能团的名称是__________________。
(2)B的结构简式为_______________,C制备D的反应条件是_____________,制备E的反应类型是_______________________。
(3)下列说法正确的是_________。
A.D是甘油的同系物
B.C是不溶于水的油状液体
C.F不能与新制氢氧化铜悬浊液反应
D.只用硝酸银溶液,就可以检出CH3CH2CH2CH2Br中是否含有溴原子
(4)写出D、F在一定条件下反应生成醇酸树脂的化学方程式________________________。
(5)芳香族化合物X是![]() 的同分异构体,X遇FeCl3溶液显紫色,可发生消去反应,其核磁共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3。写出符合要求的X的结构简式________________。
的同分异构体,X遇FeCl3溶液显紫色,可发生消去反应,其核磁共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3。写出符合要求的X的结构简式________________。
(6)请参考本题信息写出以CH3CH=CH2为原料制备化合物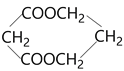 的合成线路流程图(无机试剂任选)。_______________
的合成线路流程图(无机试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定物质的量的NO2 和SO2 ,发生如下反应: NO2+ SO2![]() NO + SO3 ,达到平衡时,下列叙述正确的是
NO + SO3 ,达到平衡时,下列叙述正确的是
A、 SO2 、NO2、NO、SO3 的物质的量一定相等
B、 NO2和 SO2 的物质的量一定相等
C、平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D、NO 和 SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.l mol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3 mol/L的KCl和K2CrO4混合液中滴加1×10-3 mol/L AgNO3溶液,先生成AgCl沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-) = c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究光化学烟雾和酸雨的形成都与氮氧化物有关。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=______________(用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),△H,测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),△H,测得NO的平衡转化率与温度及压强的关系如图所示:
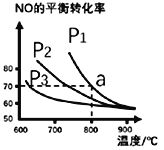
②对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,求a点的平衡常数kp=_________(MPa)1(列出计算式,分压=总压×物质的量分数)。
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了两条速率-浓度关系曲线:υ正~c(NO)和υ逆~c(CO2)

则:与曲线υ正~c(NO)相对应的是图中曲线___________ (填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,CO2和NO相应的平衡点分别为______(填字母)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-的废水,如图所示。电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
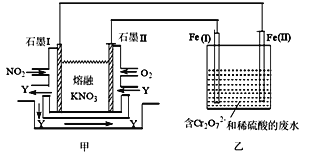
①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为___________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为________。
(4)已知H3PO4为三元酸,Ka1=7.0×10-3 mol·L-1,Ka2=6.2×10-8mol·L-1,Ka3=4.5×10-13mol·L-1。则Na2HPO4水溶液呈________ (填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
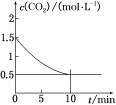
①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________ mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两相同圆底烧瓶中分别充满①NH3,②NO2倒扣于水中进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com