
【题目】含有酚类物质的废水来源广泛,危害较大。含酚废水不经处理排入水体,会危害水生生物的繁殖和生存;饮用水含酚,会影响人体健康。某科研结构研究出一种高效光催化剂BMO(Bi2MoO6),可用于光催化降解丁基酚,原理如图所示。下列说法错误的是( )
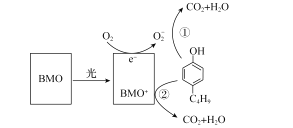
A.光催化剂BMO可降低丁基酚氧化反应的ΔH
B.在丁基酚氧化过程中BMO表现出强还原性
C.苯环上连有一OH和一C4H9的同分异构体共有12种(不考虑立体异构)
D.反应中BMO参与反应过程且可以循环利用
科目:高中化学 来源: 题型:
【题目】有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示:

已知:①A的核磁共振氢谱图中显示两组峰
②F的结构简式为:
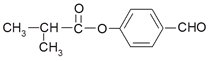
③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
④R-CH=CH2![]() R-CH2CH2OH
R-CH2CH2OH
请回答下列问题:
(1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。
(2)反应Ⅰ的反应条件是__________。
(3)E的结构简式为_______________________。
(4)写出反应Ⅴ的化学方程式____________________________________________。
(5)写出反应IV中的化学方程式____________________________________________。
(6)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件:
①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的应用中,说法正确的是( )
A. 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B. 除去MgCl2中的Fe3+,可以加入NaOH固体
C. 明矾净水的反应:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
D. 加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O。其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3·xH2O。其电池结构如图甲所示,图乙是有机高聚物的结构片段。
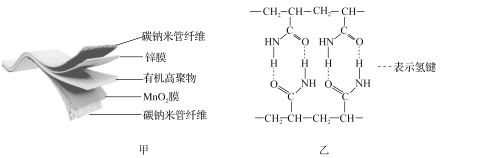
(1)Mn2+的核外电子排布式为_____;有机高聚物中C的杂化方式为_____。
(2)已知CN-与N2互为等电子体,推算拟卤(CN)2分子中σ键与π键数目之比为_____。
(3)NO2-的空间构型为_____。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。
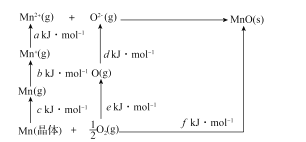
Mn的第一电离能是_____,O2的键能是_____,MnO的晶格能是_____。
(5)R(晶胞结构如图)由Zn、S组成,其化学式为_____(用元素符号表示)。已知其晶胞边长为acm,则该晶胞的密度为_____g·cm3(阿伏加德罗常数用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C![]() O”表示CO的化学键)计算X=_______ kJ·mol-1。
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
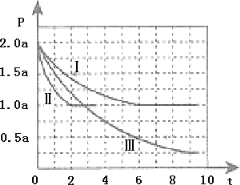
①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_____;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有的Cr2O72-和CrO42-会对水体产生很大的危害,因此这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
CrO42—![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
①中反应为2 CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O。
下列说法正确的是
A.①中,酸化后废水黄色变浅
B.②中,反应的氧化剂与还原剂的物质的量之比为3︰1
C.③中,所得沉淀Cr(OH)3中含有Fe(OH)3
D.①中,所加酸可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列两套实验装置,用于实验室制取乙酸乙酯和乙酸丁酯。下列说法错误的是
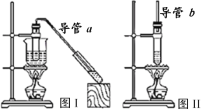
A.导管a和导管b的作用都是冷凝回流
B.都可用饱和Na2CO3溶液来洗去酯中的酸和醇
C.加入过量的乙酸可以提高醇的转化率
D.图I装置用于制取乙酸乙酯,图Ⅱ装置用于制取乙酸丁酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com