
| A. | 燃烧反应 | B. | 取代反应 | C. | 硝化反应 | D. | 加成反应 |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | HCl+NaOH═NaCl+H2O | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醛都含有醛基和烃基 | |
| B. | 羟基上氢的活性:羧酸>水>苯酚>醇 | |
| C. | 丁酸与甲酸乙酯互为同分异构体 | |
| D. | 乙二酸是最简单的二元羧酸,具有一定的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 1.00 | 21.00 |
| 3 | 25.00 | 1.20 | 21.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
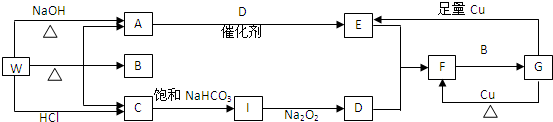
 如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.
如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com