
下列说法中正确的是( )
|
| A. | 2mol CH4的质量和O2的摩尔质量都是32g |
|
| B. | 1mol任何气体中都含有相同的原子数 |
|
| C. | 0.5molNaCl约含有6.02×1023个离子 |
|
| D. | 1mol/LKCl溶液中含有溶质1mol |
考点:
摩尔质量;物质的量的相关计算.
专题:
化学用语专题.
分析:
A、摩尔质量的单位是g/mol;
B、分子有单原子分子、多原子分子;
C、0.5molNaCl含有1mol离子,数目为6.02×1023个;
D、缺少溶液的体积,无法计算.
解答:
解:A、2molCH4的质量为2mol×16g/mol=32g,O2的摩尔质量都是32g/mol,故A错误;
B、1mol任何气体中都含有相同的分子数,原子数不一定相同,故B错误;
C、0.5molNaCl含有0.5mol钠离子和0.5mol氯离子,总共1mol离子,离子数目为1mol×6.02×1023mol﹣1=6.02×1023个,故C正确;
D、缺少溶液的体积,无法计算溶质的物质的量,故D错误;
故选C.
点评:
本题考查了物质的量的有关计算,难度一般,明确摩尔质量的单位和质量单位的区别,熟练掌握n=cV=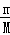 =
= 的使用条件和综合应用.
的使用条件和综合应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
实验室常用的浓盐酸中溶质的质量分数为36.5%, 密度为1.2g/cm3,.回答下列问题
(1)该浓盐酸中溶质的物质的量浓度为 .
(2)若要配制50mL 该浓盐酸,需要标准状况下HCl的体积为 。
(3)若要配制250mL 1.5mol/L的盐酸,需用量筒量取上述浓盐酸 毫升.
(4)将10ml的3mol/L的盐酸与10ml1mol/L的CaCl2溶液混合,则混合液中Cl-的物质的量浓度是 。(假设混合后溶液的体积为二者之和)
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碱金属单质的叙述正确的是( )
A. 都可以保存在煤油中
B. 随电子层数增加,熔沸点逐渐降低
C. 都是银白色金属,质软,有延展性
D. 随电子层数增加,密度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、T四种原子序数递增的短周期元素,其部分性质或结构如下:
元素编号 元素性质或原子结构
X 形成的简单阳离子核外无电子
Y 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应
Z 元素在周期表的族序数等于周期序数的3倍
T 同周期元素中形成的简单离子半径最小
下列说法正确的是( )
A. 原子半径大小顺序:T>Z>Y>X
B. 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气
C. X分别与Y、Z均可形成既含极性键又含非极性键的化合物
D. 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 D E G
3 B C J F H I
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的元素是 ,可用于制半导体材料的元素是
(2)C元素在元素周期表中的位置是 周期 族.
(3)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(4)A分别与E、G、H形成的化合物中,最稳定的;
(5)在B、C、E、F中,原子半径最大的是 .
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式 .
(7)B、H两种元素形成的化合物所含的化学键类型为
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类正确的是( )
|
| A. | 共价化合物﹣﹣硫酸、纯碱、水 | B. | 分散系﹣﹣空气、水玻璃、盐酸 |
|
| C. | 非电解质﹣﹣液氯、乙醇、NH3 | D. | 强氧化剂﹣﹣盐酸、硫酸、硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化还原反应中,水作为氧化剂的是( )
|
| A. | 3NO2+H2O═2HNO3+NO | B. | CO+H2O |
|
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce 4+ +Fe 2+ ====Fe 3+ +Ce 3+
Sn 2+ +2Fe 3+ ====2Fe 2+ +Sn 4+
由此可以确定Fe 2+ 、Ce 3+ 、Sn 2+ 三种离子的还原性由强到弱的顺序是( )
A.Sn 2+ 、Fe 2+ 、Ce 3+ B.Sn 2+ 、Ce 3+ 、Fe 2+
C.Ce 3+ 、Fe 2+ 、Sn 2+ D.Fe 2+ 、Sn 2+ 、Ce 3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com