

分析 验证浓硝酸的氧化性,应首先检查装置的气密性,硝酸与铜发生反应生成二氧化氮,通入水后生成一氧化氮,然后通过浓硝酸,如无色气体生成红棕色气体,可证明硝酸具有氧化性,可氧化一氧化氮,生成的气体不能直接排放到空气中,应有尾气处理装置,以此解答该题.
(1)根据装置特点和实验目的判断;
(2)根据空气造成的影响确定如何实施操作;同时根据一氧化氮的性质判断装置⑤的操作;
(3)根据铜和浓硝酸的性质结合实验现象判断产物,从而确定反应方程式;
(4)根据实验现象结合二氧化氮的性质书写反应方程式;
(5)根据对比实验③、④的实验现象判断;
(6)根据是否改变溶液中硝酸铜的质量分数或溶解气体的浓度判断;
解答 解:(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸.
故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出.
故答案为:通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
(3)装置①中发生反应为Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体.
故答案为:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色;
(6)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(a、c方案)再观察颜色变化,二是增大溶液中NO2浓度(d方案),通过观察颜色变化可以判断.
故选a c d.
点评 本题主要考查HNO3的性质、属物质验证性实验设计,利用对比的方法判断硝酸的性质.结合已知的物质具有的性质,选择合适的试剂,设计具体实验方案验证物质是否具有该性质.对有毒气体要设计尾气处理装置,防止污染环境.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 向两种气体中加入适量水,震荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体加压、冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
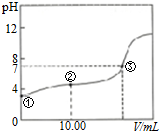
| A. | 两溶液反应的离子方程式是H++OH-+H2O | |
| B. | 图中②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| C. | 图中②点所示溶液中:c(A-)>c(H+)>c(HA)>c(OH-) | |
| D. | 图中③点所示滴入的NaOH溶液的体积V=20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验自来水中含有Cl- | B. | 检验鸡蛋壳中含有碳酸盐 | ||
| C. | 检验加碘食盐中加的不是碘单质 | D. | 除去热水瓶中的水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com