
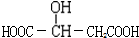 ,下列有关这种有机物的说法不正确的是( )
,下列有关这种有机物的说法不正确的是( )| A. | 苹果酸的分子式为C4H6O5 | |
| B. | 1mol苹果酸能与足量金属钠反应,能生成标准状况下的氢气22.4L | |
| C. | 1mol苹果酸能与足量碳酸氢钠溶液反应,能生成标准状况下的二氧化碳气体44.8L | |
| D. | 苹果酸在一定条件下与乙醇、乙酸均能发生酯化反应 |
分析 有机物含有羟基,可发生取代,含有羧基,具有酸性,可发生中和、酯化反应、与碳酸钠反应生成二氧化碳,-OH、-COOH均与Na反应,以此解答该题.
解答 解:A.由结构简式可知苹果酸的分子式为C4H6O5,故A正确;
B.含有2个羧基、1个羟基,则1mol苹果酸能与足量金属钠反应,能生成1.5mol氢气,标准状况下的体积为33.6L,故B错误;
C.含有2个羧基,1mol苹果酸能与足量的碳酸氢钠溶液反应,标况下生成2mol,即44.8L的二氧化碳气体,故C正确;
D.分子中含有羟基、羧基,则在一定条件下既能与醋酸反应,又能与乙醇反应,也可以自身发生酯化反应,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握有机物官能团的性质,为解答该题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它是芳香烃 | |
| B. | 1mol该物质,最多可以与1mol H2发生加成反应 | |
| C. | 与1mol该物质反应,消耗Na、NaOH、NaHCO3 的物质的量之比为2:1:1 | |
| D. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
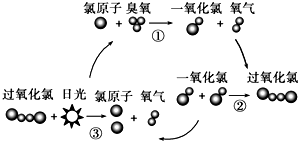 保罗•克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示.下列说法不正确的是( )
保罗•克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示.下列说法不正确的是( )| A. | 氯原子在反应中作催化剂 | |
| B. | 过氧化氯的结构式为:O-Cl-Cl-O | |
| C. | 臭氧分子最终转变成氧气分子 | |
| D. | 过程②中一氧化氯断键形成过氧化氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
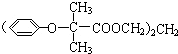 ,可用于降低血液中的胆固醇,该物质合成线路如图所示:
,可用于降低血液中的胆固醇,该物质合成线路如图所示: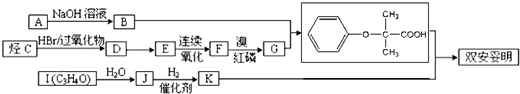
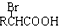 $\stackrel{苯酸钠}{→}$
$\stackrel{苯酸钠}{→}$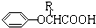
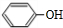 .
.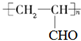
 +K→双安妥明”的化学方程式为
+K→双安妥明”的化学方程式为 .
.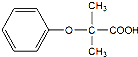 的同分异构体有6种(不考虑立体异构)
的同分异构体有6种(不考虑立体异构)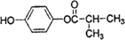 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题

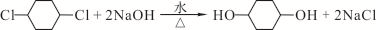 .
.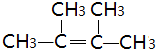 ,W是否具有顺反异构否.(填”是“或”否“)
,W是否具有顺反异构否.(填”是“或”否“)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
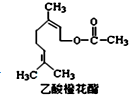 乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | 它的同分异构体中可能有芳香族化合物 | |
| B. | 能发生加成反应,但不能发生取代反应 | |
| C. | lmol该有机物在一定条件下和H2反应,共消耗H2为3mol | |
| D. | lmol该有机物水解时只能消耗lmo1NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,用PH试纸测得0.1mol•L-1 NaA溶液的PH>7 | |
| B. | 碳酸钠溶液中滴入0.1mol•L-1的HA溶液,产生大量无色气体 | |
| C. | 室温下测得某HA溶液的PH=a,用蒸馏水稀释100倍测得溶液PH=b,且b-a<2 | |
| D. | 室温下,测得0.1mol•L-1HA溶液的PH>1,证明HA是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com