
【题目】全球碳计划组织(GCP,The Global Carbon Project)报告称,2018年全球碳排放量约371亿吨,达到历史新高。
(1)中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图1所示。

①已知:CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1
2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1
则上述过程中CO和H2转化为CH2=CH2的热化学方程式是_________。
②下列有关CO2转化为汽油的说法,正确的是___________________(填标号)。
A. 该过程中,CO2转化为汽油的转化率高达78%
B. 中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C. 在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
D. 催化剂HZSM-5可以提高汽油中芳香烃的平衡产率
③若在一容器中充入一定量的CO2和H2,加入催化剂恰好完全反应,且产物只生成C5以上的烷烃类物质和水。则起始时CO2和H2的物质的量之比不低于_________。
(2)研究表明,CO2和H2在一定条件下可以合成甲醇。反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
①该反应自发进行的条件是__________(填“高温”“低温”或“任意温度”)
②催化效果最佳的催化剂是__________(填“A”“B”或“C”);b点时,![]() ________
________![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③若容器容积保持不变,则不能说明该反应达到化学平衡状态的是________。
a.c(CO2)与c(H2)的比值保持不变
b.v(CO2)正=v(H2O)逆
c.体系的压强不再发生变化
d.混合气体的密度不变
e.有lmolCO2生成的同时有断开3mol的H-H键
f.气体的平均相对分子质量不变
④已知容器内的起始压强为100 kPa,若图2中c点已达到平衡状态,则该温度下反应的平衡常数Kp =____________________(只列出计算式,不要求化简,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
【答案】2CO(g)+4H2(g)=CH2=CH2(g)+2H2O(g) H=-210kJmol-1 B 6:19 低温 A > ad 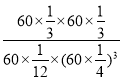
【解析】
根据已知热化学方程式运用盖斯定律书写新的热化学方程式;根据图示反应历程分析反应的中间产物,判断催化剂对反应的影响;根据烷烃的通式及题干信息进行相关计算;根据熵变和焓变判断反应是否自发进行;根据平衡状态的特征分析反应是否达到平衡状态;根据各物质的分压计算平衡常数。
(1)①已知:I CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1,II 2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1,根据盖斯定律 II-I×2 得:2CO(g)+4H2(g)=CH2=CH2(g)+2H2O(g) △H=-128 kJ·mol-1-(+ 41 kJ·mol-1)×2=-210kJmol-1,故热化学方程式为:2CO(g)+4H2(g)=CH2=CH2(g)+2H2O(g) H=-210kJmol-1;
②A. 由图示分析78%并不是表示CO2转化为汽油的转化率,故A错误;
B. 中间产物Fe5C2是无机物转化为有机物的中间产物,是转化的关键,故B正确;
C. 根据图1所示,在Na-Fe3O4上发生的反应应为CO2生成CO的反应,氢气未参加反应,故C错误;
D. 催化剂HZSM-5的作用是加快反应速率,对平衡产率没有影响,故D错误;
故答案为:B;
③烷烃的通式为CnH(2n+2),假设只生成C6H14和水,则根据原子守恒知:6molCO2恰好完全反应生成1molC6H14和12molH2O需要的H2的物质的量为:![]() ,所以CO2和H2的物质的量之比不低于6mol:19mol=6:9,故答案为:6:9;
,所以CO2和H2的物质的量之比不低于6mol:19mol=6:9,故答案为:6:9;
(2)①该反应为放热反应,△H<0,根据方程式知:△S<0,根据ΔG=ΔH-TΔS,若ΔG<0则T较小,即低温时该反应自发进行,故答案为:低温;
②如图所示相同时间内催化剂A的转化率较高,说明反应较快催化效果好;b点时,还未达到平衡,则说明![]() >
>![]() ,故答案为:A;>;
,故答案为:A;>;
③a.c(CO2)与c(H2)初始时比值为1:3,所以按照化学计量数1:3反应后,比值始终保持不变,不能说明该反应达到平衡,故a选;
b.根据化学计量数之比知:v(CO2)正=v(H2O)正=v(H2O)逆,正逆反应速率相等,则说明已经达到平衡,故b不选;
c.该反应为气体减小的反应,所以当体系的压强不再发生变化,说明反应物和生成物浓度保持不变,能说明达到平衡状态,故c不选;
d.根据质量守恒原理知,反应前后总质量始终不变,且容器体积不变,则混合气体的密度始终不变,所以气体密度不变不能说明达到平衡,故d选;
e.断开3mol的H-H键时说明有3mol氢气消耗,则应该消耗1molCO2,则CO2的浓度保持不变,能说明达到平衡状态,故e不选;
f.反应前后气体的物质的量减小,质量保持不变,则气体的平均相对分子质量应增大,若不变,说明达到平衡状态,故f不选;
故答案为:ad;
④c点时CO2的转率为80%,则反应掉1mol×80%=0.8mol,

起始状态容器中气体总物质的量为1mol+3mol=4mol,平衡时容器中气体总物质的量为0.2mol+0.6mol+0.8mol+0.8mol=2.4mol,容器体积不变,起始压强为100 kPa,则平衡时总压强为:100kPa×![]() =60kPa,根据分压=总压×物质的量分数计算得:
=60kPa,根据分压=总压×物质的量分数计算得: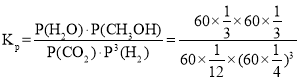 ,故答案为:
,故答案为: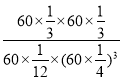 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2LH2与11.2LD2所含的质子数均为NA
B.硅晶体中,有NA个Si原子就有4NA个Si—Si键
C.6.4g Cu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子书为0.2NA
D.用惰性电极电解食盐水,若导线中通过2NA个电子,则阳极产生22.4L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图表示的一些物质或概念间的从属关系中正确的是
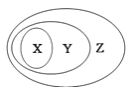
X | Y | Z | |
A | 液氯 | 非电解质 | 纯净物 |
B | 电解质 | 盐 | 化合物 |
C | 胶体 | 分散系 | 混合物 |
D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的操作方法正确的是( )
A.N2 中有少量的 CO:通过灼热的氧化铜
B.食盐中有少量的 NH4Cl:加过量的烧碱溶液后加热蒸干
C.NO 中有少量的 NO2:用水洗涤后再干燥
D.NO2 中有少量 NH3:用水洗涤后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:
______FeS2 + ______Fe2(SO4)3 +______H2O →______FeSO4 + ______H2SO4
(1)试配平反应的化学方程式,并用单线桥标出电子转移方向及数目_____;还原剂是_______,还原产物是_________,被还原的元素是__________。
(2)Fe2(SO4)3溶液呈_____性,用离子方程式解释其原因________。
(3)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:_________________________。
(4)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入__________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
(5)实验室.配制一定量FeSO4溶液时,需加入少量_____和_______其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:

已知:RCHO+CH3CHO![]() RCH(OH)CH2CHO。
RCH(OH)CH2CHO。
试回答:
(1)A的结构简式是_________,E→F的反应类型是_________。
(2)B→C反应的化学方程式为_____________。
(3)C→D所用试剂和反应条件分别是_________。E中官能团的名称是________________。
(4)检验F中碳碳双键的方法是_________________________。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有______种(除D外)。其中苯环上只有一个取代基,核磁共振氢谱有4个峰,峰面积比为3∶2∶2∶1的同分异构体的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol,5min末达到平衡,此时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol·L-1·min-1。
3C(g)+nD(g),开始时A为4mol,B为6mol,5min末达到平衡,此时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol·L-1·min-1。
计算:
(1)平衡时A的物质的量浓度为___。
(2)前5min内用B表示的化学反应速率v(B)为___。
(3)化学方程式中n值为__。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol·L-1·min-1
②v(B)=6mol·L-1·min-1
③v(C)=4.5mol·L-1·min-1
④v(D)=8mol·L-1·min-1
其中反应速率最快的是__(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
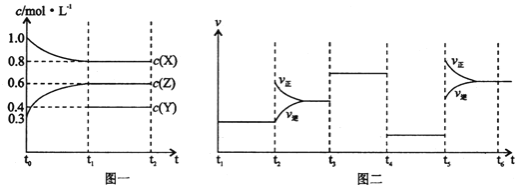
A.Y的起始物质的量为0.5mol
B.该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g)H<0
3Z(g)H<0
C.若t0=0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol/(L·s)
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com