
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应
式是:Zn+2OH--2e-===ZnO+H2O; Ag2O+H2O+2e-===2Ag+2OH- 下列说法
正确的是
A.Zn为正极,Ag2O为负极
B.Ag2O发生还原反应
C.原电池工作时,正极区溶液pH值减小
D.原电池工作时,负极区溶液pH值增大
科目:高中化学 来源: 题型:
某厂废水中含5.00×2013-3mol·L-1的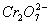 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料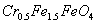 (
(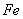 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
(1)第①步反应的离子方程式是
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(4)欲使1L该废水中的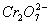 完全转化为
完全转化为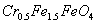 。理论上需要加入
。理论上需要加入
GFeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.lmol· 醋酸溶液加水稀释,下列说法正确的是( )
醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(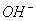 )都减小 B.溶液中c(H+)增大
)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K= 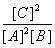
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
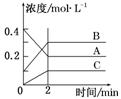
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)  2B(g) +C(g)
2B(g) +C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/ mL | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m= ,
n= 。如果研究温度对化学反应速率的影响,需利用实验4和 。
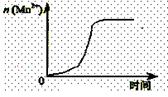 (2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 |
| t3 |
②能说明该小组同学提出的假设成立的实验事实是 。
(3)有人将酸性KMnO4 溶液和H 2C2O4 溶液的反应设计成原电池,则该原电池的正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
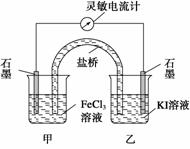
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
某些溶液中含有的杂质用一般方法难以除去,而用电解法则是一种很有效的方法。以下杂质(括号内为杂质)不能用惰性电极电解法除去的是( )
A. Na2SO4溶液(CuSO4) B. NaNO3溶液(CuCl2)
C. MgSO4溶液(CuCl2) D. NaNO3溶液(MgCl2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com