
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

(1)a点(横坐标为10)所示溶液中离子浓度从大到小的顺序为___________________ ,其中c(Na+)______c(A-)+c(HA)(填“>”“<”或“=”)。
(2)c点所示溶液中,c(Na+)_____c(A-)(填“>”“<”或“=”)。
(3)b点所示溶液中,c(A-)_____c(HA)(填“>”“<”或“=”)。
(4)a、b、c点所示溶液中,水的电离程度最大的是__________________________。
(5)以下滴定操作会导致V(HA)偏大的是____________。
A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、滴定开始前读数时平视,滴定终点,读数时俯视
【答案】 c(Na+)>c(A-)>c(OH-)>c(H+) = = > a A
【解析】本题考查离子浓度大小比较、误差分析,(1)a点,消耗HA的体积为10mL,两者恰好完全反应,反应后溶质为NaA,此时溶液显碱性,说明A-为弱酸根离子,发生A-+H2O ![]() HA+OH-,因此离子浓度为c(Na+)>c(A-)>c(OH-)>c(H+);根据物料守恒,c(Na+)=c(A-)+c(HA);(2)c点时,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),溶液的pH显中性,c(H+)=c(OH-),即c(Na+)=c(A-);(3)b点溶质为NaA和HA,且两种物质的物质的量相等,此时溶液显酸性,说明HA的电离程度大于A-水解程度,即c(HA)<c(A-);(4)a点时,溶质为NaA,A-发生水解,促进水的电离,b、c点时HA过量,对水的电离抑制,因此水的电离程度最大的时a点;(5)A、滴定前有气泡,滴定后气泡消失,V(HA)偏大,故A正确;B、锥形瓶中有无干燥,对实验无影响,V(HA)不变,故B错误;C、锥形瓶有液体溅出,锥形瓶中溶质物质的量减少,消耗HA的体积减小,故C错误;D、滴定前平视读数,滴定终点,俯视读数,消耗V(HA)减小,故D错误。
HA+OH-,因此离子浓度为c(Na+)>c(A-)>c(OH-)>c(H+);根据物料守恒,c(Na+)=c(A-)+c(HA);(2)c点时,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),溶液的pH显中性,c(H+)=c(OH-),即c(Na+)=c(A-);(3)b点溶质为NaA和HA,且两种物质的物质的量相等,此时溶液显酸性,说明HA的电离程度大于A-水解程度,即c(HA)<c(A-);(4)a点时,溶质为NaA,A-发生水解,促进水的电离,b、c点时HA过量,对水的电离抑制,因此水的电离程度最大的时a点;(5)A、滴定前有气泡,滴定后气泡消失,V(HA)偏大,故A正确;B、锥形瓶中有无干燥,对实验无影响,V(HA)不变,故B错误;C、锥形瓶有液体溅出,锥形瓶中溶质物质的量减少,消耗HA的体积减小,故C错误;D、滴定前平视读数,滴定终点,俯视读数,消耗V(HA)减小,故D错误。


科目:高中化学 来源: 题型:
【题目】有一块镁铝合金,其中镁与铝的质量比是8∶9。加入200mL稀HNO3使其恰好完全溶解,产生NO气体在标准状况下的体积为3.36L,然后向溶液中再加入NaOH溶液至沉淀质量不再发生变化,过滤、洗涤、干燥、称量。
(1)合金中铝的物质的量为_________,最后所得沉淀的质量为_________。
(2)另取200 mL原稀HNO3和300 mL稀硫酸组成混合液,向其中加铜粉使之充分反应,得到只含一种溶质的溶液,求所加稀硫酸的物质的量浓度。(无解题过程不给分)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 gmL﹣1 , 沸点约为55℃.要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
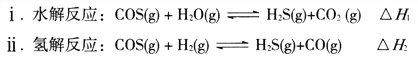
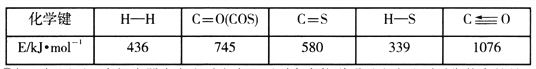
已知反应中相关的化学键键能数据如下表:
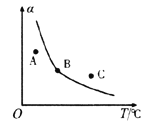
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
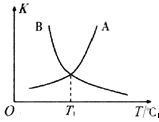
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为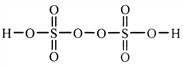
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗高血压药物洛沙坦是一种结构复杂的有机物,H是合成洛沙坦的一种中间体,其合成路线如下:

已知:I.
II. 酯和醇可发生如下交换反应:
(1)有机物H中含氧官能团的名称是_________。
(2)C![]() D 的反应类型是_________。
D 的反应类型是_________。
(3)A是饱和一元醇,A![]() B反应的化学方程式为_________。
B反应的化学方程式为_________。
(4)1 mol E水解生成2 mol CH3OH,E的结构简式是__________。
(5)E跟乙二醇在一定条件下能够发生反应生成聚合物,写出此反应的化学方程式_________。
(6)通过多步反应,将E分子中引入-NH2可得到F,F分子存在较好的对称关系,F的结构简式是_________。
(7)下列说法正确的是_______。(填字母)
a.A能发生取代反应、氧化反应、消去反应
b.1 mol H与足量的银氨溶液反应,能生成1 mol Ag
c.已知烯醇式结构![]() 不稳定,而G却可以稳定存在,其原因可能是由于基团间的相互影响
不稳定,而G却可以稳定存在,其原因可能是由于基团间的相互影响
(8)写出同时满足下列条件的F的一种同分异构体的结构简式_________。
a.与F具有相同种类和个数的官能团
b.能发生银镜反应
c.其核磁共振氢谱显示有四种不同化学环境的氢,峰面积比为2∶4∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是
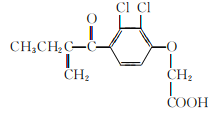
A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的碳原子最多有10个
C. 1mol利尿酸能与6molH2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HA为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列不正确的是
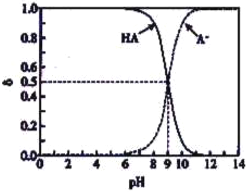
A. 常温下,HA的电离平衡常数Ka=10-9 B. x=0时,1<pH<7
C. x=5时,C(A-)=c(HA) D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com