
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 | B.HF是还原产物 |
| C.还原剂和氧化剂的物质的量之比是2:1 | D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:单选题
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用
化学方程式表示如下:2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
对此反应下列说法中正确的是( )
| A.Na2O2只作氧化剂 | B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2是还原产物 | D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在酸性溶液中的还原性强弱顺序为:SO2 >I–>H2O2>Fe2+>Cl–,下列反应不可能发生的是:
| A.H2O2+ H2SO4=SO2↑+ O2↑+2 H2O |
| B.2I– +2Fe3+=I2+2 Fe2+ |
| C.2Fe3++ SO2 +2H2O=2Fe2++SO42– +4H+ |
| D.SO2 +2 H2O+ I2=H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,当有10 mol电子发生转移后,被氧化的氯原子与被还原的氯原子的物质的量之比是
| A.1∶5 | B.5∶1 | C.6∶1 | D.1∶6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:1lP+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法错误的是:
| A.生成1 mol H3PO4时,有5 mol电子转移 |
| B.5molCuSO4参加反应时,被氧化的P为1mol |
| C.氧化产物和还原产物的物质的量之比为6:5 |
| D.6molH3PO4生成时,被CuSO4氧化的P为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原子质量为56)。下列有关分析错误的是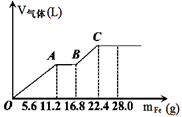
| A.原混合酸中NO3-的物质的量为0.2 mol |
| B.原混合酸中H2SO4物质的量浓度为2mol/L |
| C.OA段与BC段反应中电子转移的物质的量之比为2:1 |
| D.取20mL原混合酸加水稀释至1L后溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C. 30 mL | D. 15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
| A.KClO3是氧化剂 |
| B.被氧化与被还原的氯元素的质量比为5:1 |
| C.H2SO4既不是氧化剂又不是还原剂 |
| D.1molKClO3参加反应时有10mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
给汽车安装尾气净化装置,汽车尾气通过净化装置(内有钯等过渡金属元素做催化剂)后,其中的有害气体CO、NO转化为无害气体N2、CO2,则
| A.NO作为还原剂 | B.CO作为还原剂 | C.N2作为还原剂 | D.CO2作为氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com