


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
 请回答下列问题:
请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
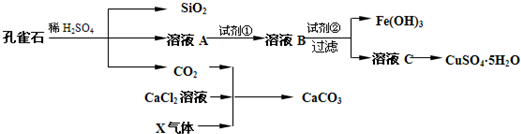
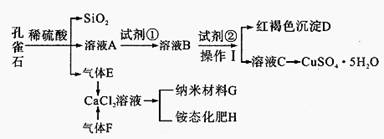
孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的 。
a.KMnO4 b.NaOH c.H2O2 d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是 。该工厂选用试剂①最好为下列中的 (填代号)。
a.H2O2 b.空气 c.Cl2 d.KSCN
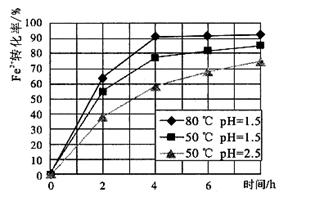
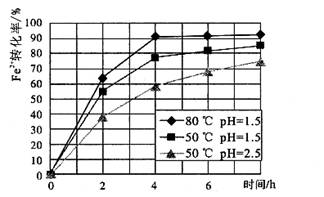
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是 。
(5)向溶液B中加入试剂②的化学式为 ,操作I的名称是 。
(6)气体E和气体F应该先通人CaCl2溶液中的是 (填化学式)。写出制备G和H的化学反应方程式 。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为 。取A溶液20.00mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 。
查看答案和解析>>
科目:高中化学 来源:2012届福建省漳州市芗城中学高三适应性检测化学试卷(带解析) 题型:填空题
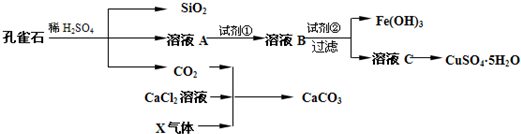
孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5 H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省漳州市高三适应性检测化学试卷(解析版) 题型:填空题
孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5 H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
|
物质 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe(OH)3 |
2.2 |
3.2 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Cu(OH)2 |
4.7 |
6.4 |
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的 。
a.KMnO4 b.NaOH c.H2O2 d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是 。该工厂选用试剂①最好为下列中的 (填代号)。
a.H2O2 b.空气 c.Cl2 d.KSCN
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是 。
(5)向溶液B中加入试剂②的化学式为 ,操作I的名称是 。
(6)气体E和气体F应该先通人CaCl2溶液中的是 (填化学式)。写出制备G和H的化学反应方程式 。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为 。取A溶液20.00 mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 。
查看答案和解析>>
科目:高中化学 来源:2011年北京市高考化学模拟试卷(一)(解析版) 题型:填空题
 请回答下列问题:
请回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com