
(1)在实验室中作小型实验:把物质A、B按一定比例充入一个表面积为![]() 的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应
的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应![]() ,若平均每分钟生成0.5 mol的C,容器表面向外散热速率平均为
,若平均每分钟生成0.5 mol的C,容器表面向外散热速率平均为![]() 为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
答:_________________________________________.
(2)若将(1)的小型实验扩大为工业生产:将反应容器的底面半径和高度都扩大到原容器的10倍,做成“相似体”,并向其中将A、B按原比例充入,使压强仍为P,然后加热到280℃使反应开始.为了维持恒温280℃,反应开始后,应继续加热还是进行冷却?(设容器表面散热速率不变)
平均每分钟用加热器向体系提供或者用冷却器吸收了多少kJ的热量.(简述推理过程)
答:________________________________________.
(3)在恒温、恒压下,向(2)的“相似体”平衡体系中将A、B按原比例充入,重新达到平衡时,C的体积分数_________.
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
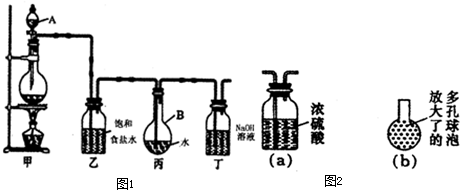
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
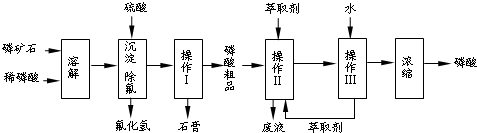
查看答案和解析>>
科目:高中化学 来源:2013届吉林省吉林一中高三上学期阶段验收化学试卷(带解析) 题型:实验题
(10分)制备无水乙醇的实验
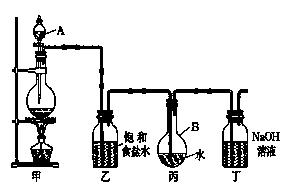
原理:由于乙醇95.6%、水4.4%组成一种混合物,常压下,它有一定的沸点(78.17℃),这个沸点低于水的(100℃)也低于纯乙醇的沸点(78.3℃),所以只靠简单蒸馏酒精,所得乙醇纯度最高只能达到95.6%尚含有4.4%的水.如果要得到含量较高的乙醇,在实验室中常用的简便方法是加人生石灰回流(回流是在一个可以加热的反应容器中,把液体加热使受热转化生成的蒸气通过冷凝器冷凝又回流到原容器的操作.见图甲),回流之后再蒸馏,可得99.5%的乙醇,通常称为无水乙醇.如果要得到纯度更高的绝对乙醇(含乙醇99.95%),则还要用金属钠进行处理,借以除去最后微量的水份。
实验步骤::取干燥的250mL圆底烧瓶一只,加入95%乙醇100mL和小块生石灰30g,振摇后用橡皮塞塞紧,放置过夜。在烧瓶口装上回流冷凝管,管口接一支氯化钙干燥管(装置见图甲),在水浴上加热回流1至2小时,稍冷,取下冷凝管,改装成蒸馏装置(如图乙),再放在热水浴中蒸馏,把最初蒸出的5mL馏出液另外回收,然后用烘干的吸滤瓶作为接受器,其侧管接一支氯化钙干燥管,使其与大气相通,蒸至无液滴出来为止,量取所得乙醇的体积,计算回收率。请回答;
(1)为什么回收或蒸馏时都要装上氯化钙干燥管?____________________________
(2)为了防止回流系统外部湿气侵入,有人用塞子把冷凝管上端塞紧,这样做为什么不行?___________________________________________
(3)无水氯化钙常用作吸水剂,如用无水氯化钙代替氧化钙投入酒精中,放置过夜,然后不经过滤,进行本实验制取乙醇是否可行,为什么?__________________________
(4)一般用干燥剂干燥有机物时,在蒸馏前应先过滤,但用氯化钙制备无水乙醇时,为什么可不过滤,留在瓶中一起蒸馏?__________________________________
(5)为什么最初蒸出的5mL馏出液另外收集,它的纯度是否已达99.5%?
________________________________________________
查看答案和解析>>
科目:高中化学 来源:2011届上海市嘉定区高三上学期第一次质量调研化学试卷 题型:实验题
Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
| A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏; |
| B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶; |
| C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小; |
| D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大; |
 微粒符号表示 );
微粒符号表示 ); _______________________________________________________________________
_______________________________________________________________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com