
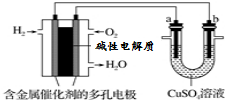
| A. | 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 | |
| B. | 若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O=4OH- | |
| D. | 电子经导线流入b电极 |
分析 燃料电池中,通入氢气的电极为负极、通入氧气的电极为正极,则b是阴极、a是阳极,
A.此装置用于电镀铜时,阳极溶解的金属等于阴极析出的金属;
B.电解精炼时,粗铜作阳极、纯铜作阴极;
C.燃料电池中,正极上氧气得电子和水反应生成氢氧根离子;
D.电子从负极沿导线流向b电极、从a电极流向正极.
解答 解:燃料电池中,通入氢气的电极为负极、通入氧气的电极为正极,则b是阴极、a是阳极,
A.此装置用于电镀铜时,阳极溶解的金属铜等于阴极析出的金属Cu,所以电解质溶液中铜离子相当于不参加反应,则其浓度不变,故A正确;
B.电解精炼时,粗铜作阳极、纯铜作阴极,所以若a为粗铜,b为纯铜,该装置可用于粗铜的精炼,故B错误;
C.燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应为O2+4e-+2H2O=4OH-,故C正确;
D.电子从负极沿导线流向b电极、从a电极流向正极,故D正确.
故选B.
点评 本题考查了原电池和电解池原理,根据燃料电池中得失电子确定正负极,再结合电解池中离子放电顺序分析解答,注意电解质溶液中阴阳离子定向移动形成电流,电子不进入电解质溶液,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 丙烷的比例模型是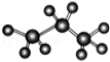 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 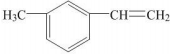 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为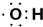 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略).下列设计不能达到目的是( )
如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略).下列设计不能达到目的是( )| 选项 | 气体 | 装置中药品 | ||
| a | b | C | ||
| A | C2H2 | 饱和食盐水+电石 | CuSO4溶液 | 溴水 |
| B | CO2 | 稀盐酸+石灰石 | 饱和NaHCO3溶液 | 苯酚的溶液 |
| C | C2H4 | 溴乙烷+NaOH乙醇溶液 | 水 | K2Cr2O7酸性溶液 |
| D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.
A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
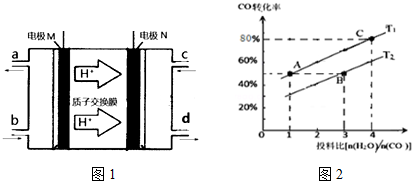
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
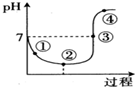 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备氢氧化铁胶体:向沸腾的NaOH溶液中,滴加氯化铁饱和溶液,煮沸至红褐色 | |
| B. | 提纯含少量苯酚的苯:加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验亚硫酸钠是否变质:将试样溶解后加入氯化钡溶液,观察实验现象 | |
| D. | 比较铁与铜的活泼性:将铜粉加入1.0 mol•L-1 Fe2(SO4)3溶液中,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
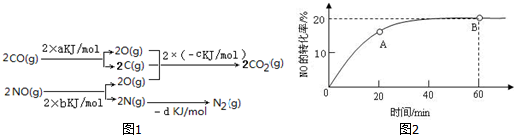
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com