
| A. | 量筒、酸式滴定管、水 | B. | 容量瓶、碱式滴定管、苯 | ||
| C. | 量筒、碱式滴定管、水 | D. | 容量瓶、酸式滴定管、四氯化碳 |
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | ||
| C. | 既无氧化性又无还原性 | D. | 既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
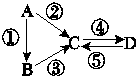 根据物质性质完成下列题型.
根据物质性质完成下列题型.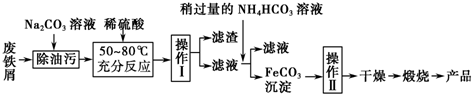
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与硫酸氢钠溶液混合:HCO3-+H+═H2O+CO2↑ | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
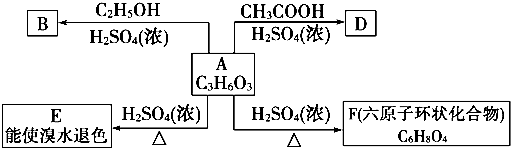
 ;反应类型:消去反应;
;反应类型:消去反应; ;反应类型:酯化反应或取代反应.
;反应类型:酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸或醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1KI溶液中加入0.1 mol•L-1 FeCl3溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
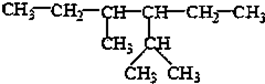 的系统命名为2,4-二甲基-3-乙基乙烷.
的系统命名为2,4-二甲基-3-乙基乙烷.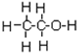 乙烯的电子式
乙烯的电子式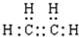
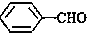
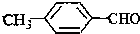 <
<
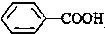 >CH3COOH(提示:类比酚和醇的酸性)
>CH3COOH(提示:类比酚和醇的酸性)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
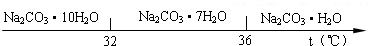
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
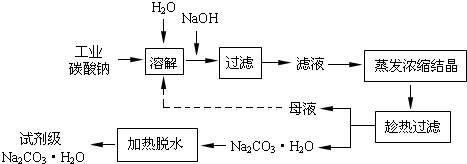
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com