
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
分析 由①中现象可知:NaBiO3把Mn2+氧化生成MnO4-,则NaBiO3得电子作氧化剂,NaMnO4为氧化产物;
由②中现象可知:NaMnO4氧化H2O2产生O2,则NaMnO4为氧化剂,氧气为氧化产物;
由③中现象可知:碘离子被双氧水氧化成单质碘,则NaMnO4为氧化剂,碘单质为氧化产物,
结合氧化剂的氧化性大于氧化产物的氧化性这一规律来回答判断.
解答 解:氧化剂的氧化性大于氧化产物的氧化性,
由①中现象可知:NaBiO3把Mn2+氧化生成MnO4-,则NaBiO3(氧化剂)的氧化性强于NaMnO4(氧化产物)的氧化性;
由②中现象可知:NaMnO4氧化H2O2产生O2,自身被还原为Mn2+,则NaMnO4(氧化剂)的氧化性强于H2O2的氧化性;
由③中现象可知:碘离子被双氧水氧化成单质碘,则双氧水(氧化剂)的氧化性强于碘单质(氧化产物)的氧化性;
综上所述,NaBiO3、NaMnO4、I2、H2O2的氧化性由强到弱的顺序是:NaBiO3>NaMnO4>H2O2>I2,
故答案为:NaBiO3>NaMnO4>H2O2>I2.
点评 本题考查学生氧化还原反应中氧化性强弱的判断规律知识,注意氧化剂的氧化性强于氧化产物的氧化性这一规律是关键,难度不大.


科目:高中化学 来源: 题型:解答题
 如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.
如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的酸性:w>Z>x | |
| B. | 化合物Q中存在两种类型的共价键 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 347kJ/mol | B. | 368 kJ/mol | C. | 386 kJ/mol | D. | 414 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 由0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合而成 | |
| C. | 由0.1 mol/LCH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| D. | 向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O?HCO3-+OH- | |
| B. | 烧碱溶液与小苏打溶液混合:OH-+HCO3-=H2O+CO32- | |
| C. | 硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO2↑ | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
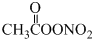 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com