
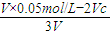 =0.01mol/L计算;
=0.01mol/L计算;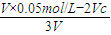 =0.01mol/L,解得c(NaOH)=0.01 mol?L-1,
=0.01mol/L,解得c(NaOH)=0.01 mol?L-1,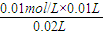 =0.005 mol?L-1,
=0.005 mol?L-1,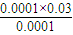 ×100%=3%,
×100%=3%,

 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温条件下,将0.05 mol·L![]() 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
(2)C(HA)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:
h =(已水解的物质的量÷原来总物质的量)×100﹪.求上述所得NaA溶液的水解度。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省温州中学高二下学期期中考试化学试卷 题型:计算题
在常温条件下,将0.05 mol·L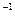 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
(2)C(HA)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:
h =(已水解的物质的量÷原来总物质的量)×100﹪.求上述所得NaA溶液的水解度。
查看答案和解析>>
科目:高中化学 来源:2013届浙江东阳中学、兰溪一中高二下学期期中考试化学卷(解析版) 题型:计算题
在常温条件下,将0.05
mol·L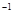 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
(1)C( NaOH)。
(2)C(HA)。
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:h =(已水解的物质的量÷原来总物质的量)×100﹪。求上述所得NaA溶液的水解度。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下学期期中考试化学试卷 题型:计算题
在常温条件下,将0.05 mol·L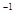 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA
20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA
20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
(2)C(HA)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:
h =(已水解的物质的量÷原来总物质的量)×100﹪.求上述所得NaA溶液的水解度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com