
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
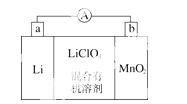
(1)外电路的电流方向是由________极流向________极。(填字 母)
母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),
原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为红色,说明原溶液中一定
含有( )
A.Fe3+ B.Fe2+ C.Cu2+ D.Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是( )
①混合物:铝热剂、福尔马林、水玻璃、漂白粉 ②化合物:氯化钙、烧碱、冰水混合物、胆矾 ③电解质:明矾、二氧化碳、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨
A.①②④ B.②③④
C.①②⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源。它依靠跟人体内体液中含有的一定浓度的溶解氧、H+和Zn2+进行工作,试写出该电池的两极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法 正确的是( )
正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
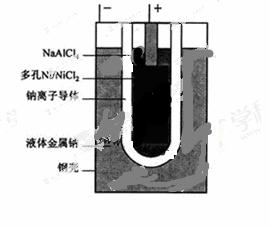
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还 原三价铝离子
原三价铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是( )。

A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
A、H2O(g)==H2(g)+1/2O2( g) △H =—485KJ/mol
g) △H =—485KJ/mol
B、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C、2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0,t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0,t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是 ( )
A.500 s 内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.达平衡时,N2O5的转化率为50%
C.达平衡后,升高温度平衡常数减小
D.达平衡后其他条件不变,将容器体积压缩到原来的一半,c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com