
| A. | 钢 | B. | 液氯 | C. | 玻璃 | D. | 氨水 |
科目:高中化学 来源: 题型:解答题
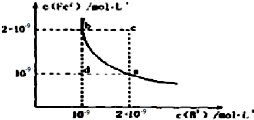
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K的原子结构示意图  | B. | CO2的结构式 O-C-O | ||
| C. | C-12原子的表示方法:C612 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 | |
| D. | c2d2中各原子的最外层均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁的金属性比铝弱 | |
| B. | 镁和铝的氧化物都可以与盐酸反应 | |
| C. | 镁和铝原子的最外层电子数都为3 | |
| D. | 镁和铝的氧化物都可以与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用托盘天平称取10.60 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol/L NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
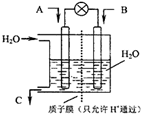 面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com