
【题目】以明矾![]() 为原料制备Al、
为原料制备Al、![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
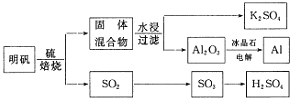
依据上述流程图回答下列问题:
![]() 写出明矾和硫单质混合焙烧发生反应的化学方程式______.
写出明矾和硫单质混合焙烧发生反应的化学方程式______.
![]() 从水浸后的滤液中得到
从水浸后的滤液中得到![]() 晶体的方法是蒸发浓缩、______、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______.
晶体的方法是蒸发浓缩、______、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______.
![]() 电解
电解![]() 时加入冰晶石的作用是______.
时加入冰晶石的作用是______.
![]() 以Al和
以Al和![]() 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时![]() 转化为
转化为![]() ,该电池反应的化学方程式是______.
,该电池反应的化学方程式是______.
![]() 焙烧产生的
焙烧产生的![]() 可用于制硫酸.已知
可用于制硫酸.已知![]() ,101kPa时:
,101kPa时:
![]()
![]()
![]()
则![]() 和
和![]() 反应的热化学方程式是______.
反应的热化学方程式是______.
![]() 焙烧948吨明矾
焙烧948吨明矾![]() ,若
,若![]() 的利用率为
的利用率为![]() ,则可生产多少吨质量分数为
,则可生产多少吨质量分数为![]() 的硫酸?
的硫酸?
【答案】4KAl(SO4)2·12H2O+2S![]() 2Al2O3+2K2SO4+9SO2↑+48H2O 冷却结晶 蒸发皿、玻璃棒、酒精灯、三脚架 降低
2Al2O3+2K2SO4+9SO2↑+48H2O 冷却结晶 蒸发皿、玻璃棒、酒精灯、三脚架 降低![]() 的熔化温度,节约能源
的熔化温度,节约能源 ![]()
![]()
【解析】
![]() “焙烧”过程中得到
“焙烧”过程中得到![]() 与固体混合物,而固体混合物进行水浸,过滤得到
与固体混合物,而固体混合物进行水浸,过滤得到![]() 与
与![]() ,则焙烧”过程中得到
,则焙烧”过程中得到![]() 、
、![]() 、
、![]() ,同时有水生成,配平化学方程式;
,同时有水生成,配平化学方程式;
![]() 从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,实验室在蒸发浓缩过程中用到的主要仪器有:蒸发皿、玻璃棒、酒精灯、三脚架;
从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,实验室在蒸发浓缩过程中用到的主要仪器有:蒸发皿、玻璃棒、酒精灯、三脚架;
![]() 的熔点很高,电解时加入冰晶石降低
的熔点很高,电解时加入冰晶石降低![]() 的熔化温度,可以节约能源;
的熔化温度,可以节约能源;
![]() 以Al和
以Al和![]() 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时![]() 转化为
转化为![]() ,发生还原反应,则Al发生氧化反应,碱性条件下得到
,发生还原反应,则Al发生氧化反应,碱性条件下得到![]() ,配平书写方程式;
,配平书写方程式;
![]() 和
和![]() 发生反应为:
发生反应为:![]() ,根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减,构造目标热化学方程式,反应热也进行相应的运算;
,根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减,构造目标热化学方程式,反应热也进行相应的运算;
![]() 将
将![]() 的利用率转化为
的利用率转化为![]() 的利用率,由焙烧”过程中反应方程式,及硫元素守恒,可得关系式:
的利用率,由焙烧”过程中反应方程式,及硫元素守恒,可得关系式:![]() ,据此计算.
,据此计算.
![]() “焙烧”过程中得到
“焙烧”过程中得到![]() 与固体混合物,而固体混合物进行水浸,过滤得到
与固体混合物,而固体混合物进行水浸,过滤得到![]() 与
与![]() ,则焙烧”过程中得到
,则焙烧”过程中得到![]() 、
、![]() 、
、![]() ,同时有水生成,发生反应为:4KAl(SO4)2·12H2O+2S
,同时有水生成,发生反应为:4KAl(SO4)2·12H2O+2S![]() 2Al2O3+2K2SO4+9SO2↑+48H2O;
2Al2O3+2K2SO4+9SO2↑+48H2O;
故答案为:4KAl(SO4)2·12H2O+2S![]() 2Al2O3+2K2SO4+9SO2↑+48H2O;
2Al2O3+2K2SO4+9SO2↑+48H2O;
![]() 从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,实验室在蒸发浓缩过程中用到的主要仪器有:蒸发皿、玻璃棒、酒精灯、三脚架,
从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,实验室在蒸发浓缩过程中用到的主要仪器有:蒸发皿、玻璃棒、酒精灯、三脚架,
故答案为:冷却结晶;蒸发皿、玻璃棒、酒精灯、三脚架;
![]() 的熔点很高,电解时加入冰晶石降低
的熔点很高,电解时加入冰晶石降低![]() 的熔化温度,可以节约能源,
的熔化温度,可以节约能源,
故答案为:降低![]() 的熔化温度,节约能源;
的熔化温度,节约能源;
![]() 以Al和
以Al和![]() 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时![]() 转化为
转化为![]() ,发生还原反应,则Al发生氧化反应,碱性条件下得到
,发生还原反应,则Al发生氧化反应,碱性条件下得到![]() ,该电池反应的化学方程式是:
,该电池反应的化学方程式是:![]() ,
,
故答案为:![]() ;
;
![]() 和
和![]() 发生反应为:
发生反应为:![]() ,
,
已知:![]()
![]()
![]()
根据盖斯定律,![]() 得:
得:![]() ,
,
故答案为:![]() ;
;
![]() 设可生产x吨质量分数为
设可生产x吨质量分数为![]() 的硫酸,则:
的硫酸,则:![]() :
:![]() :
:![]()
解得![]() ,
,
答:可生产432吨质量分数为![]() 的硫酸。
的硫酸。


科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
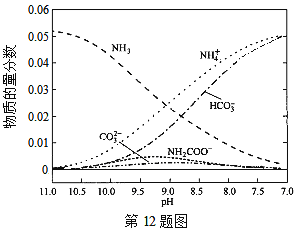
A.在pH=9.0时,c(NH4+)>c(HCO)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,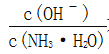 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是( )
选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
|
A | 浓盐酸 | MnO2 固体 | 立即产生大量黄绿色气体 | |
B | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生大量气体 | |
C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
D | NaOH 溶液 | 用砂纸打磨过的铝条 | 产生大量气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
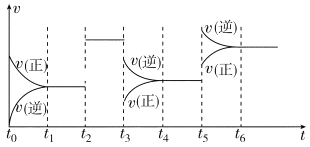
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间内X转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
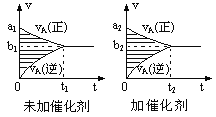
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
A. ②④⑤⑦B. ①④⑥⑧C. ②③⑤⑧D. ①③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
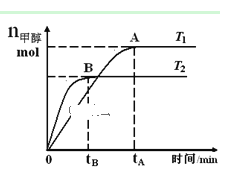
A.平衡常数K =![]()
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素在周期表中的位置为__。
(2)NH3的电子式为__。
(3)下列事实能说明Y 元素的非金属性比S 元素的非金属性强的是__。
a.Y 单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)常温下,碳与镁形成的 1 mol 化合物Q 与水反应,生成2 mol Mg(OH)2和 1 mol 气态烃,该烃中碳氢质量比为 9:1。写出化合物Q 与水反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空密闭容器中盛有1 mol PCl5,加热到200 ℃,发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
A.m>nB.m<nC.m=nD.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com