
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
分析 A、小苏打即碳酸氢钠,受热易分解;
B、二氧化硫有漂白性;
C、BaCO3能和胃酸盐酸反应;
D、醋酸的酸性强于碳酸.
解答 解:A、小苏打即碳酸氢钠,受热易分解生成二氧化碳气体,从而使面食疏松多孔,故小苏打能于面粉发酵,故A正确;
B、二氧化硫有漂白性,能漂白纸浆,故B正确;
C、BaCO3能和胃酸盐酸反应,生成氯化钡,是重金属盐,能使人中毒,故不能做钡餐,做钡餐的是硫酸钡,故C错误;
D、醋酸的酸性强于碳酸,故醋酸能和水垢的主要成分碳酸钙反应,生成可溶性的醋酸钙,从而除去水垢,故D正确.
故选C.
点评 本题考查了化学物质在生活和生产中的应用,难度不大,应注意的是做钡餐的是硫酸钡,而不是碳酸钡.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
将下列溶液与1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液c(Cl-)最大的是
A.50 mL 1 mol·L-1 NaCl溶液 B.20 mL 2 mol·L-1 A lCl3溶液
lCl3溶液
C.30 mL 1 mol·L-1 MgCl2溶液 D.100 mL 3 mol·L-1 KClO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
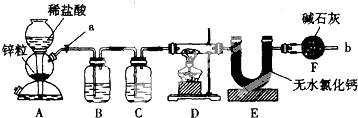
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚2-甲基-1-丙烯可以通过加聚反应制得 | |
| B. | 聚2-甲基-1-丙烯的分子式为 (C4H8)n | |
| C. | 聚2-甲基-1-丙烯完全燃烧生成CO2和H2O的物质的量相等 | |
| D. | 聚2-甲基-1-丙烯能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
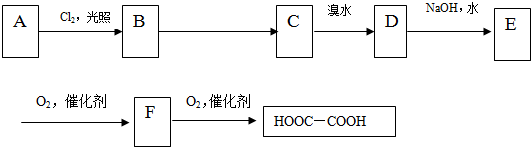
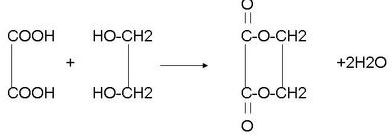 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为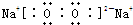 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com