
已知:
①H2(g)+ O2(g)===H2O(g) ΔH1=a kJ·mol-1
O2(g)===H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=c kJ·mol-1
O2(g)===H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH3=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )
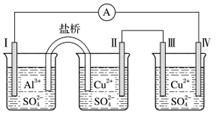
A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?______________________________________________
________________________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)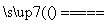 CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A.ΔH2>ΔH3
B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2
D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2013·新课标全国卷Ⅰ,28(3)]二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(ⅰ)CO(g)+2H2(g)===CH3OH(g)
ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH2=-49.0 kJ·mol-1
水煤气变换反应:(ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:(ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)??2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)??(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)??NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)??2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+ O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:__________________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
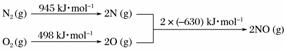
写出该反应的热化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
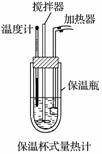
在量热计(如图)中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从298.0 K升高到300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·K-1(已知CH3COOH电离要吸热)。
(1)CH3COOH的中和热ΔH=_____________________________________________。
(2)CH3COOH中和热的文献值为-56.1 kJ·mol-1,你认为造成(1)中测得的实验值有偏差的可能原因是_______________________________________________________________________。
(3)实验中NaOH溶液过量的目的是_______________________________________________。
(4)你认为CH3COOH的中和热与盐酸的中和热绝对值相比,__________的较大,其原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
求算下列常温下溶液中由H2O电离的c(H+)和c(OH-)。
(1)pH=2的H2SO4溶液
c(H+)=__________,c(OH-)=__________。
(2)pH=10的NaOH溶液
c(H+)=__________,c(OH-)=__________。
(3)pH=2的NH4Cl溶液
c(H+)=__________。
(4)pH=10的Na2CO3溶液
c(OH-)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)酸式滴定管装标准溶液前,必须先用该溶液润洗( )
(2014·新课标全国卷Ⅰ,12B)
(2)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差( )
(2014·新课标全国卷Ⅰ,12C)
查看答案和解析>>
科目:高中化学 来源: 题型:
Na位于元素周期表第____周期第____族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com