
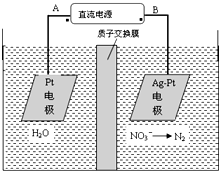
| A.A为电源正极 |
| B.阳极反应式为:2H2O-4e-═4H++O2↑ |
| C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为10.4克 |
| D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |


科目:高中化学 来源:不详 题型:单选题
| A.AgNO3 | B.NaNO3 | C.Mg(NO3)2 | D.Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
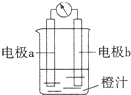
| A.原电池是将化学能转化成电能的装置 |
| B.原电池的负极发生氧化反应 |
| C.图中a极为镁条、b极为锌片时,导线中会产生电流 |
| D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲中铜片是负极 |
| B.两烧杯中铜片表面均无气泡产生 |
| C.产生气泡的速度甲比乙快 |
| D.两烧杯中溶液的pH均减小 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl与NaOH反应 |
| B.SO3与H2O反应 |
| C.H2与O2反应 |
| D.Ba(OH)2?8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B.某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥中可以是由KCl饱和溶液制得的琼脂 |
| C.因为铁的活动性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D.理论上说,任何能自发进行的氧化还原反应都可被设计成原电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.③④ | C.③④⑤ | D.④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com