
下列关于醇的物理性质的说法中正确的是( )
A.“酒香不怕巷子深”的说法说明了乙醇容易挥发
B.所有的醇在常温下均为液态
C.醇类物质都易溶于水,并且随着分子内羟基数目的增多,溶解性增强
D.由于醇分子中存在氢键,使得相对分子质量相近的醇比烷烃的熔沸点高
科目:高中化学 来源: 题型:
能在水溶液中大量共存的一组离子是( )
A.H+、I-、NO 、SiO
、SiO
B.Ag+、Fe3+、Cl-、SO
C.K+、SO 、Cu2+、NO
、Cu2+、NO
D.NH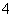 、OH-、Cl-、HCO
、OH-、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中的固体剩余物是( )
A.Na2CO3和Na2O2
B.Na2CO3和NaOH
C.NaOH和Na2O2
D.NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铝、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题:
(1)铝的原子结构示意图为________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是________________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:________________________。
(3)如图K82所示的装置中,铁作________极,铜电极的电极反应式为________________。
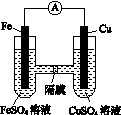
图K82
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热,并通入氯气,可得到氯化铝,同时生成CO。写出该反应的化学方程式:________________________________________。该反应中的氧化剂是________。
(6)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知丙二醇的结构简式为 ,下列关于丙二醇的说法正确的是( )
,下列关于丙二醇的说法正确的是( )
A.丙二醇可发生消去反应生成丙炔
B.丙二醇可由丙烯在一定条件下与水加成制得
C.丙烯与溴水加成后,再与NaOH醇溶液共热水解可得丙二醇
D.丙二醇在铜存在下催化氧化可得到丙二醛
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1 mol分子式为C3H8O的液体有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A的分子式必有一个__________基。若A分子中只有一个—CH3,完成(2)(3)中的填空:
(2)A与浓硫酸共热,分子内脱去1分子水,生成B。B的结构简式为__________。B通入溴水能发生__________反应生成C,C的结构简式为__________。A在有铜作催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为__________。
(3)写出下列反应的化学方程式:
①A―→B_____________________________________________;
②B―→C_____________________________________________;
③A―→D_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
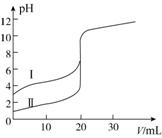
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1∶4 B.1∶2
C.2∶1 D.4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com